Cele
Po zakończeniu tego działu, powinieneś być w stanie
- napisać równanie opisujące tworzenie cyjanohydryny z aldehydu lub ketonu.
- zidentyfikować cyjanohydrynę powstałą w reakcji danego aldehydu lub ketonu z cyjanowodorem.
- zidentyfikować aldehyd lub keton, odczynniki lub oba te elementy potrzebne do przygotowania danej cyjanohydryny.
- opisać szczegółowy mechanizm addycji cyjanowodoru do aldehydu lub ketonu.
Kluczowe pojęcia
Upewnij się, że potrafisz zdefiniować, i użyć w kontekście, kluczowego pojęcia poniżej.
- cyanohydryna
Informacje dodatkowe
Dla pomyślnego utworzenia cyjanohydryny ważne jest, aby mieć wolne jony cyjankowe dostępne do reakcji z ketonem lub aldehydem. Można to osiągnąć przez zastosowanie soli (np. KCN lub NaCN) lub sililowanej (np. Me3SiCN) formy cyjanku w warunkach kwaśnych lub przez zastosowanie HCN z dodatkiem zasady w celu wytworzenia potrzebnego nukleofila CN-.
Cyjanowodór (HC≡N), przyłącza się odwracalnie do aldehydów i wielu ketonów tworząc addukty hydroksyalkanenitrylowe (powszechnie znane i nazywane cyjanohydrynami). Cyjanohydryny mają wzór strukturalny R2C(OH)CN. „R” we wzorze reprezentuje alkil, aryl lub wodór.
Rysunek 19.6.1: Ogólna reakcja tworzenia cyjanohydryny
Ważną cechą tworzenia cyjanohydryny jest to, że wymaga ona katalizatora zasadowego. Ponieważ cyjanowodór sam w sobie jest kwasem (pKa = 9,25), najlepsze wyniki uzyskuje się, gdy niewielka ilość silnej zasady aktywuje cyjanowodór, przekształcając go w jon cyjankowy ((-)C≡N), który może działać jako nukleofil węglowy. W przypadku braku zasady reakcja nie przebiega, a w najlepszym przypadku jest bardzo powolna. Tworzenie cyjanohydryny jest słabo egzotermiczne i jest preferowane dla aldehydów oraz niezakłóconych cyklicznych i metylowych ketonów.
W praktycznych syntezach cyjanohydryn wygodnie jest dodać silny kwas do mieszaniny cyjanku sodu i związku karbonylowego, tak że cyjanowodór jest generowany in situ. Ilość dodawanego kwasu powinna być niewystarczająca, aby pochłonąć cały jon cyjankowy, dlatego utrzymywane są wystarczająco zasadowe warunki dla szybkiej addycji.
Ponadto, wykazano, że katalizowana kwasem hydroliza sililowanych cyjanohydryn (R3SiCN) jest źródłem cyjanowodoru do tworzenia cyjanohydryn nawet z silnie utrudnionych ketonów.
2 (CH3)3SiCN + H2O → (CH3)3SiOSi(CH3)3 + 2 HCN
Cyjanowodór przyłącza się w poprzek wiązania podwójnego węgiel-tlen w aldehydach i ketonach, tworząc związki znane jako hydroksynitryle. Na przykład, z etanalem (aldehydem) otrzymujemy 2-hydroksypropanenitryl:
Z propanonem (ketonem) otrzymujemy 2-hydroksy-2-metylopropanenitryl:
Reakcji zwykle nie przeprowadza się z użyciem samego cyjanowodoru, ponieważ jest to niezwykle trujący gaz. Zamiast tego, aldehyd lub keton miesza się z roztworem cyjanku sodu lub potasu w wodzie, do którego dodaje się odrobinę kwasu siarkowego. pH roztworu jest dostosowywane do około 4-5, ponieważ wtedy reakcja przebiega najszybciej. Roztwór będzie zawierał cyjanowodór (z reakcji między cyjankiem sodu lub potasu a kwasem siarkowym), ale nadal będzie zawierał pewne ilości wolnych jonów cyjankowych. Jest to ważne dla mechanizmu.
Mechanizm powstawania cyjanohydryny
1) W pierwszym etapie jon cyjankowy działa jako nukleofil i tworzy wiązanie z elektrofilowym węglem karbonylowym. Dwa elektrony w karbonylowym wiązaniu pi są wypychane do elektronegatywnego tlenu tworząc tetraedryczny jon alkoksydowy.
2) Jon alkoksydowy jest protonowany przez HCN, który regeneruje jon cyjankowy.
Dalsza chemia cyjanohydryn
Grupy funkcyjne cyjanohydryn często okazują się użyteczne ze względu na dalszą chemię, którą można prowadzić ze względu na obecność funkcji hydroksylowej i nitrylowej. W szczególności, dehydratacja może przekształcić grupę hydroksylową w alken (rozdział 17.6). Nitryl można przekształcić w grupę funkcyjną kwasu karboksylowego w wyniku reakcji z gorącym kwaśnym roztworem wodnym (sekcja 20.7). Nitryl może być również zredukowany przez dodanie LiAlH4 w celu utworzenia aminy pierwszorzędowej. Tworzenie cyjanohydryny pozwala na łatwe przekształcenie aldehydów i ketonów w wiele różnych grup funkcyjnych.
Inne cyjanohydryny
Inne ciekawe cyjanohydryny to: mandelonitryl, cyjanohydryna acetonu i glikolonitryl.
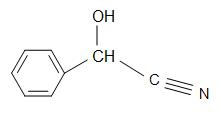

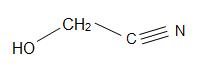
Struktury madelonitrylu (po lewej), Cyjanohydryny acetonowej (w środku) i glikolonitrylu (po prawej)
Mandelonitryl ma wzór strukturalny C6H5CH(OH)CN i występuje w pestkach niektórych owoców. Aceton cyjanohydryny ma strukturę, (CH3)2C(OH)CN, i jest używany w produkcji metakrylanu metylu (znany również jako akryl). Glikolonitryl jest związkiem organicznym o wzorze strukturalnym HOCH2CN, który jest najprostszą cyjanohydryną pochodzącą od formaldehydów.
Problemy
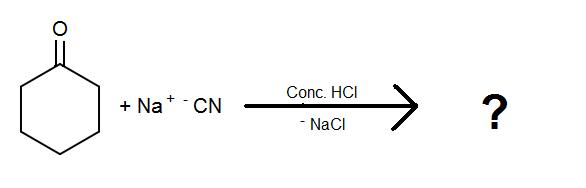
Podsumuj następujące reakcje dla cyjanohydryn:
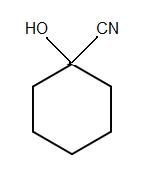
1)
2)
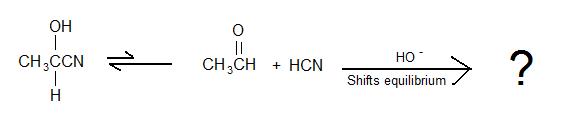
3) Prawda czy fałsz: Aby powstała cyjanohydryna, przeprowadza się szybką addycję silnego kwasu do soli cyjankowej w celu przekształcenia soli w HCN.
4) Prawda czy Fałsz: Reakcje cyjanohydrynowe są nieodwracalne.
5) Jaki jest produkt dla reakcji ogólnej?
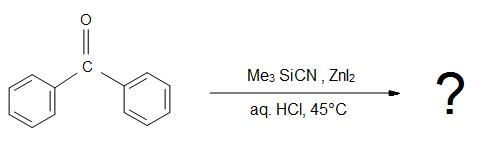
Odpowiedzi
1)
2)
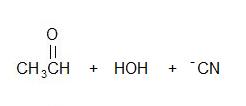
3) Fałsz, wolne dodawanie
4) Fałsz, odwracalne
5)
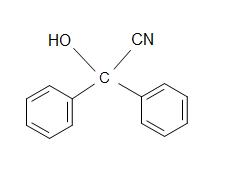
Wykonawcy i przypisy
-
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
-
Jim Clark (Chemguide.co.uk)