Ziele
Nach Abschluss dieses Abschnitts sollten Sie in der Lage sein,
- eine Gleichung zur Beschreibung der Bildung eines Cyanohydrins aus einem Aldehyd oder Keton zu schreiben.
- Identifizieren Sie das Cyanhydrin, das bei der Reaktion eines gegebenen Aldehyds oder Ketons mit Cyanwasserstoff entsteht.
- Bestimmen Sie den Aldehyd oder das Keton, die Reagenzien oder beides, die zur Herstellung eines bestimmten Cyanhydrins benötigt werden.
- Schreiben Sie den detaillierten Mechanismus für die Addition von Cyanwasserstoff an einen Aldehyd oder ein Keton.
Schlüsselbegriffe
Stellen Sie sicher, dass Sie den folgenden Schlüsselbegriff definieren und im Zusammenhang verwenden können.
- Cyanhydrin
Studienhinweise
Für eine erfolgreiche Cyanhydrinbildung ist es wichtig, dass freie Cyanidionen zur Reaktion mit dem Keton oder Aldehyd zur Verfügung stehen. Dies kann durch die Verwendung eines Salzes (z.B. KCN oder NaCN) oder einer silylierten (z.B. Me3SiCN) Form von Cyanid unter sauren Bedingungen oder durch die Verwendung von HCN mit einem Basenzusatz erreicht werden, um das benötigte CN-Nukleophil zu erzeugen.
Wasserstoffcyanid (HC≡N) addiert reversibel an Aldehyde und viele Ketone und bildet Hydroxyalkannitril-Addukte (allgemein bekannt und als Cyanohydrine bezeichnet). Cyanohydrine haben die Strukturformel von R2C(OH)CN. Das „R“ in der Formel steht für ein Alkyl, Aryl oder Wasserstoff.
Abbildung 19.6.1: Allgemeine Reaktion der Cyanhydrinbildung
Ein wichtiges Merkmal der Cyanhydrinbildung ist, dass sie einen basischen Katalysator benötigt. Da Cyanwasserstoff selbst eine Säure ist (pKa = 9,25), werden die besten Ergebnisse erzielt, wenn eine kleine Menge einer starken Base den Cyanwasserstoff aktiviert, indem sie ihn in ein Cyanidion ((-)C≡N) umwandelt, das als Kohlenstoff-Nukleophil fungieren kann. In Abwesenheit einer Base verläuft die Reaktion nicht oder bestenfalls sehr langsam. Die Cyanohydrinbildung ist schwach exotherm und wird von Aldehyden und ungehinderten cyclischen und Methylketonen begünstigt.
In praktischen Synthesen von Cyanohydrinen ist es zweckmäßig, eine starke Säure zu einem Gemisch aus Natriumcyanid und der Carbonylverbindung hinzuzufügen, so dass Blausäure in situ entsteht. Die zugegebene Säuremenge sollte nicht ausreichen, um das gesamte Cyanid-Ion zu verbrauchen, daher werden ausreichend alkalische Bedingungen für eine schnelle Addition aufrechterhalten.
Auch die säurekatalysierte Hydrolyse von silylierten Cyanohydrinen (R3SiCN) hat sich als Quelle für Cyanwasserstoff erwiesen, um Cyanohydrine auch mit stark gehinderten Ketonen zu bilden.
2 (CH3)3SiCN + H2O → (CH3)3SiOSi(CH3)3 + 2 HCN
Benzinwasserstoff addiert über die Kohlenstoff-Sauerstoff-Doppelbindung in Aldehyden und Ketonen, um Verbindungen zu bilden, die als Hydroxynitrile bekannt sind. Zum Beispiel erhält man mit Ethanal (einem Aldehyd) 2-Hydroxypropannitril:
Mit Propanon (einem Keton) erhält man 2-Hydroxy-2-methylpropannitril:
Die Reaktion wird normalerweise nicht mit Blausäure selbst durchgeführt, da diese ein extrem giftiges Gas ist. Stattdessen wird der Aldehyd oder das Keton mit einer Lösung von Natrium- oder Kaliumcyanid in Wasser vermischt, der ein wenig Schwefelsäure zugesetzt wurde. Der pH-Wert der Lösung wird auf etwa 4 – 5 eingestellt, da dies die schnellste Reaktion ergibt. Die Lösung enthält Blausäure (aus der Reaktion zwischen dem Natrium- oder Kaliumcyanid und der Schwefelsäure), aber immer noch einige freie Cyanid-Ionen. Dies ist wichtig für den Mechanismus.
Mechanismus der Cyanohydrinbildung
1) Im ersten Schritt wirkt das Cyanid-Ion als Nukleophil und bildet eine Bindung mit dem elektrophilen Carbonyl-Kohlenstoff. Die beiden Elektronen der Carbonyl-pi-Bindung werden auf den elektronegativen Sauerstoff geschoben und bilden ein tetraedrisches Alkoxid-Ion als Zwischenprodukt.
2) Das Alkoxid-Ion wird durch HCN protoniert, wodurch das Cyanid-Ion regeneriert wird.
Weitere Chemie von Cyanohydrinen
Cyanohydrin-Funktionsgruppen erweisen sich oft als nützlich, da durch das Vorhandensein einer Hydroxyl- und Nitrilfunktionalität eine weitere Chemie durchgeführt werden kann. Insbesondere kann durch Dehydratisierung die Hydroxylgruppe in ein Alken überführt werden (Abschnitt 17.6). Das Nitril kann durch Reaktion mit einer heißen sauren wässrigen Lösung in eine Carbonsäurefunktionsgruppe umgewandelt werden (Abschnitt 20.7). Auch kann das Nitril durch Zugabe von LiAlH4 zu einem primären Amin reduziert werden. Durch die Bildung eines Cyanohydrins lassen sich Aldehyde und Ketone leicht in eine Vielzahl von funktionellen Gruppen überführen.
Weitere Cyanohydrine
Weitere interessante Cyanohydrine sind: Mandelonitril, Acetoncyanohydrin und Glycolonitril.
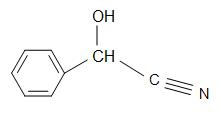

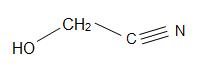
Strukturen von Madelonitril (links), Acetoncyanhydrin (Mitte) und Glycolonitril (rechts)
Mandelonitril hat die Strukturformel C6H5CH(OH)CN und kommt in den Kernen einiger Früchte vor. Acetoncyanhydrin hat die Strukturformel (CH3)2C(OH)CN und wird zur Herstellung von Methylmethacrylat (auch bekannt als Acryl) verwendet. Glycolonitril ist eine organische Verbindung mit der Strukturformel HOCH2CN, die das einfachste Cyanhydrin ist, das sich von Formaldehyden ableitet.
Aufgaben
Vervollständigen Sie die folgenden Reaktionen für Cyanohydrine:
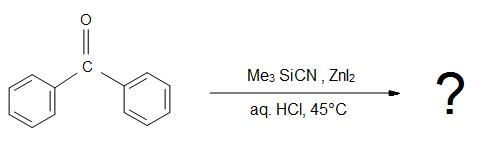
1)
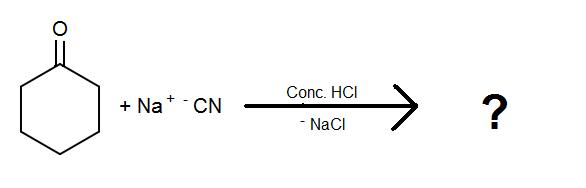
2)
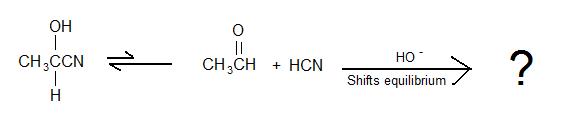
3) Richtig oder falsch: Für die Bildung eines Cyanhydrins wird eine schnelle Zugabe einer starken Säure zum Cyanidsalz durchgeführt, um das Salz in HCN umzuwandeln.
4) Richtig oder falsch: Cyanhydrin-Reaktionen sind irreversibel.
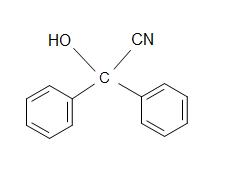
5) Wie lautet das Produkt der Gesamtreaktion?
Antworten
1)
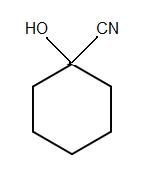
2)
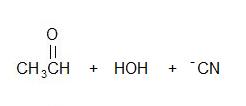
3) Falsch, langsame Addition
4) Falsch, reversibel
5)
Beiträger und Zuschreibungen
-
Dr. Dietmar Kennepohl FCIC (Professor für Chemie, Athabasca University)
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
-
Jim Clark (Chemguide.co.uk)