Enzyme, sogenannte Kinasen, katalysieren die Übertragung von Phosphorylgruppen auf organische Moleküle. Die Quelle der Phosphorylgruppe in den meisten Phosphorylierungsreaktionen ist ein Molekül namens Adenosintriphosphat, abgekürzt ATP.
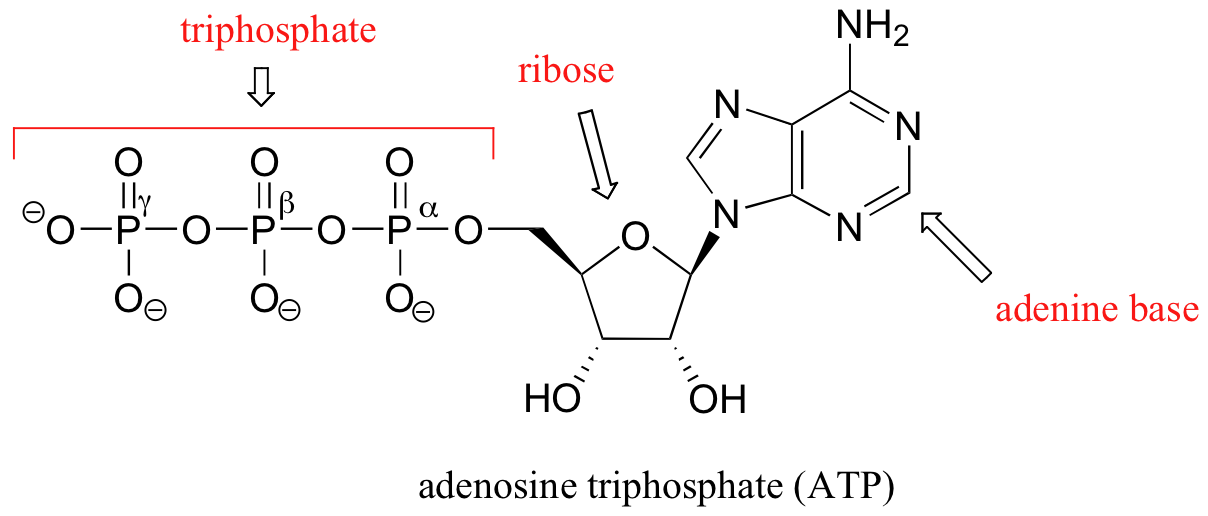
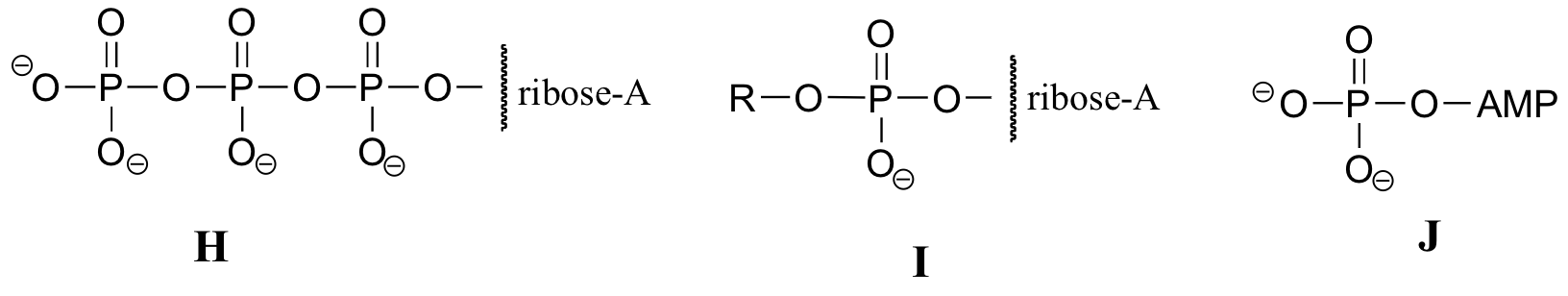
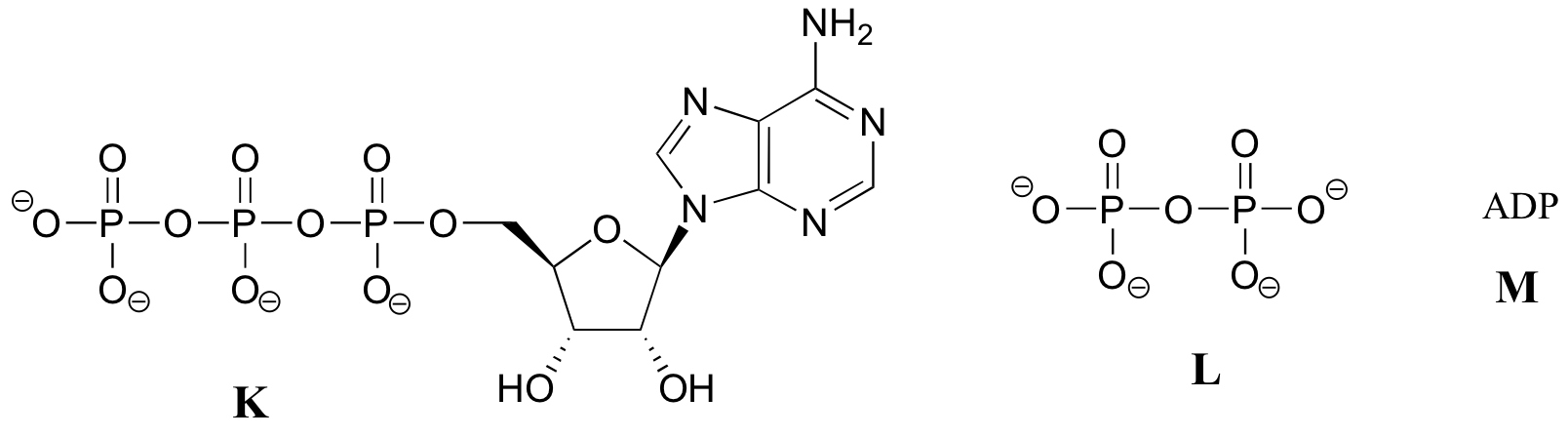
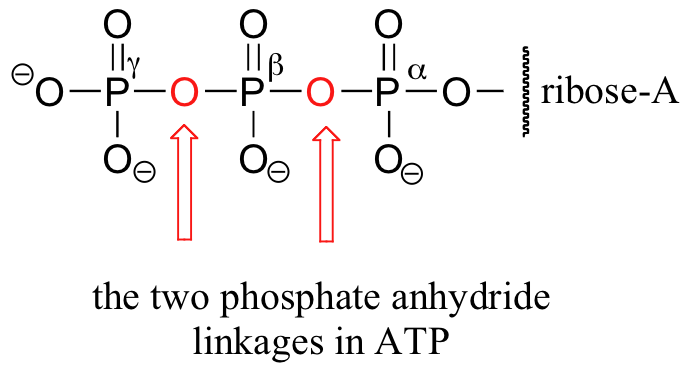
Beachten Sie, dass das Molekül im Wesentlichen aus drei Teilen besteht: einer Adenin-Nukleosid-Base, einem Fünf-Kohlenstoff-Zucker (Ribose) und einer Triphosphatgruppe. Die drei Phosphate werden mit den griechischen Buchstaben a, b und g bezeichnet. Adenosindiphosphat (ADP) und Adenosinmonophosphat (AMP) sind ebenfalls wichtige Akteure in den Reaktionen dieses Kapitels.
Sie werden ATP, ADP und AMP in diesem Text und in der gesamten biochemischen Literatur auf viele verschiedene Arten abgekürzt sehen. Zum Beispiel sind die drei folgenden Strukturen alle abgekürzte Darstellungen von ATP:
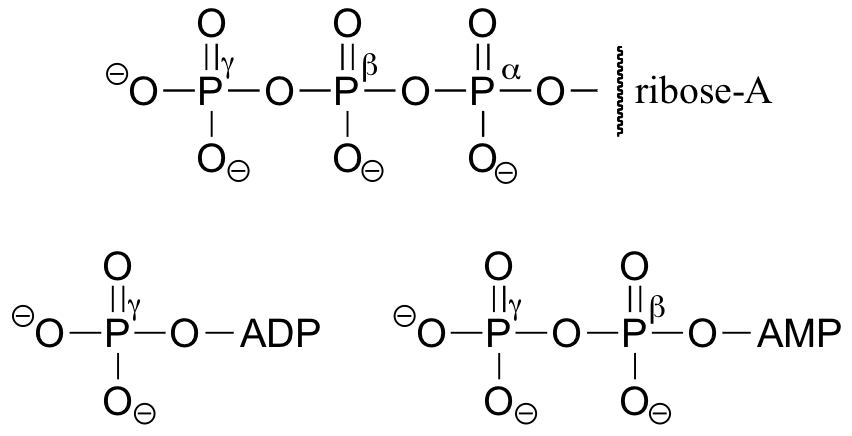
Die folgende Übung soll Ihnen helfen, die verschiedenen Abkürzungen für biologische Moleküle, die Phosphatgruppen enthalten, zu erkennen.
Vorlage:BeispielStart
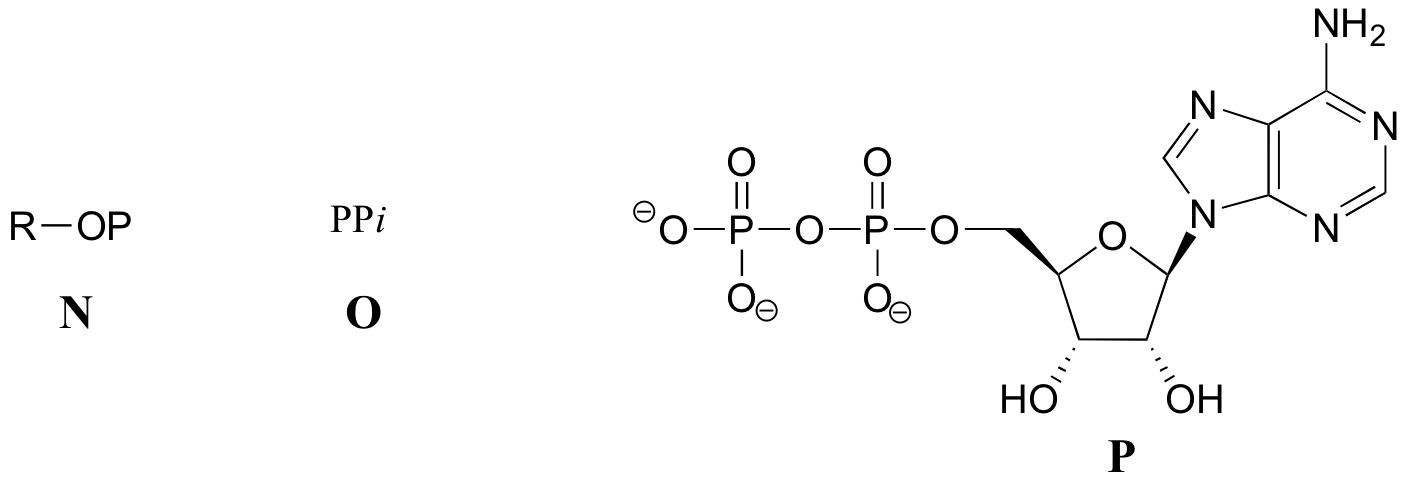
Übung 10.2: Nachfolgend finden Sie eine Reihe von Darstellungen, beschriftet mit A-S, von Molekülen, die Phosphorylgruppen enthalten. Es werden unterschiedliche Abkürzungen verwendet. Ordnen Sie A-S in Gruppen von Zeichnungen an, die das gleiche Molekül darstellen, wobei unterschiedliche Abkürzungen (oder gar keine Abkürzung) verwendet werden.
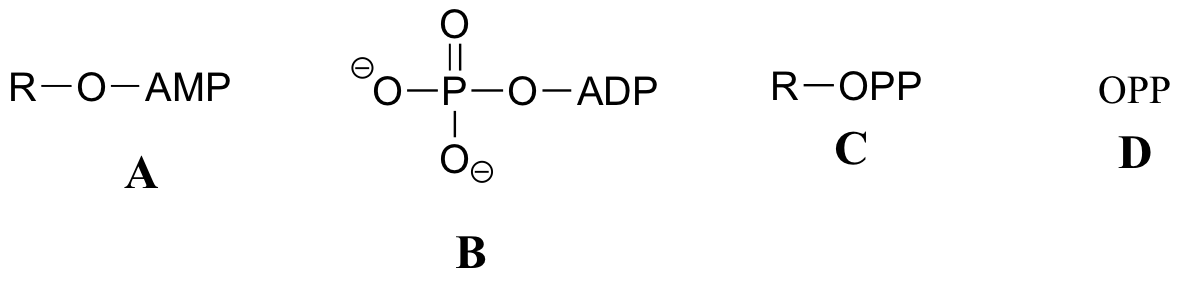
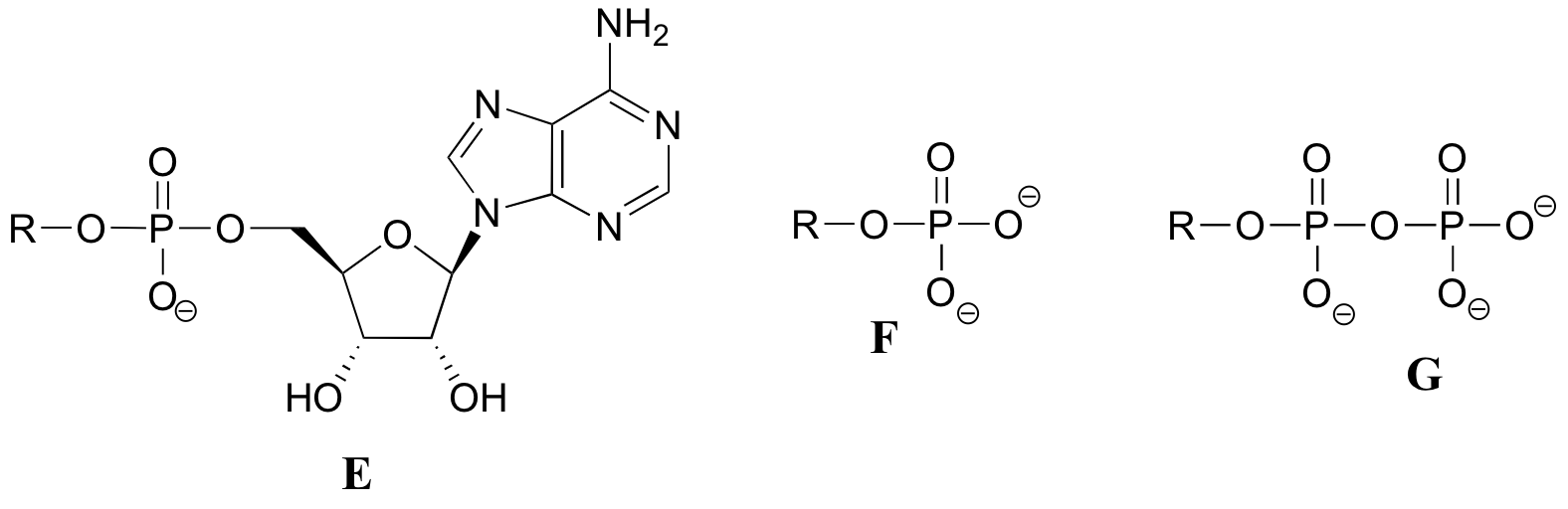

Wenn wir davon sprechen, dass die Energie eines ATP-Moleküls „verbraucht“ wird, meinen wir damit, dass eine Phosphorylgruppe von ATP auf ein anderes Akzeptormolekül übertragen wird, wodurch das Akzeptormolekül reaktiver wird. Zum Beispiel wird bei vielen Phosphoryl-Transfer-Reaktionen (wie der Phosphorylierung von Glucose, die wir in Abschnitt 10.1D als Beispiel verwendet haben) das Gamma-(γ)-Phosphat von ATP auf einen organischen Akzeptor übertragen, wodurch ADP freigesetzt wird.
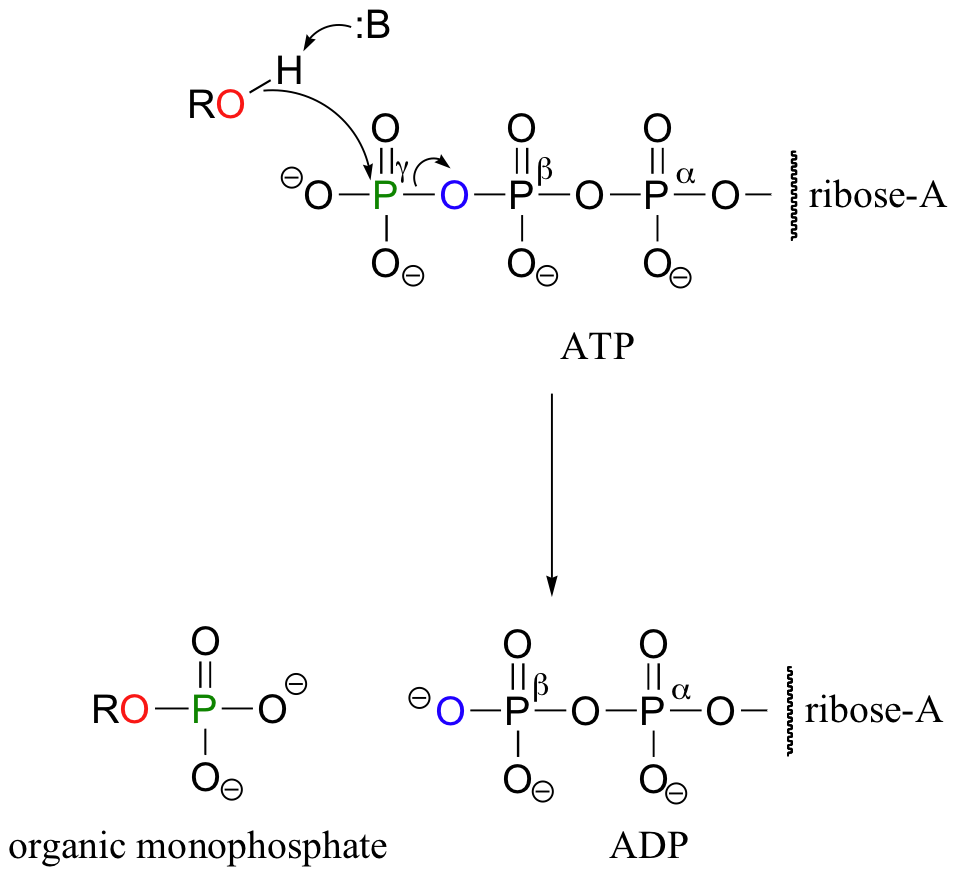
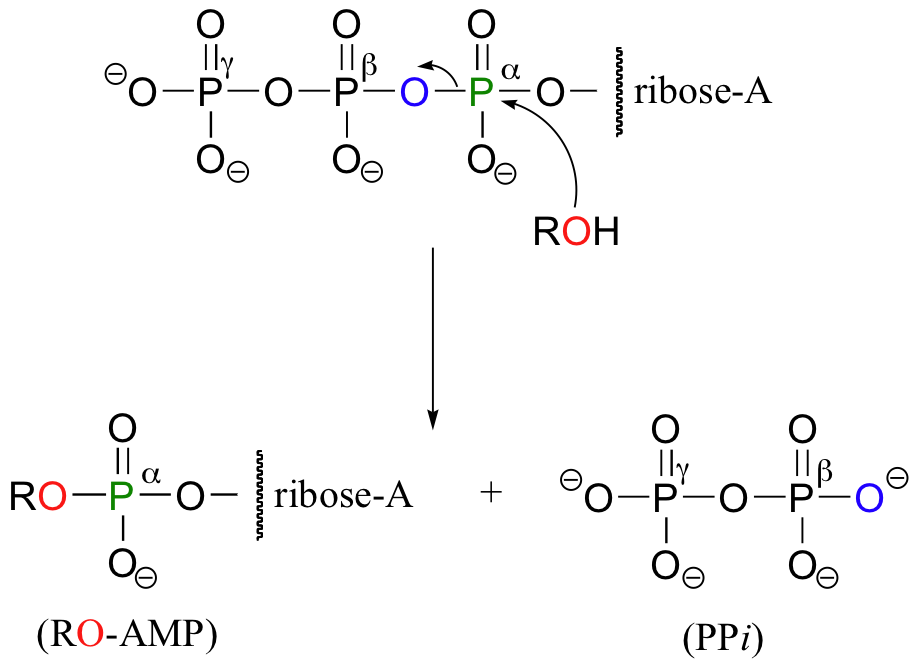
In anderen Reaktionen wird die Base, Ribose, und das Alpha-Phosphat auf das organische Molekül übertragen, um ein organisches-AMP-Addukt zu bilden, während anorganisches Pyrophosphat (PPi) freigesetzt wird.
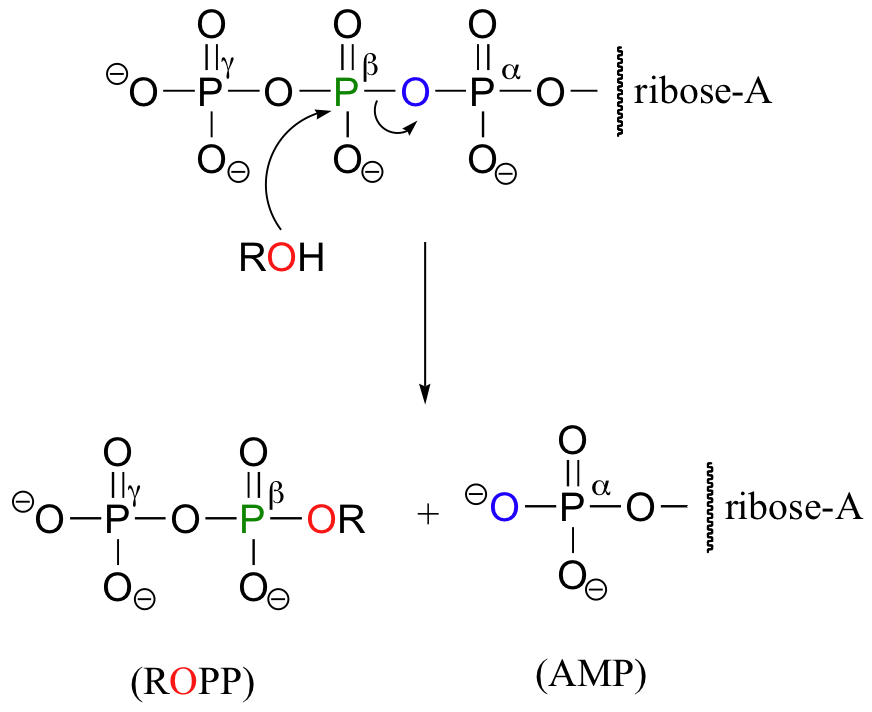
Gelegentlich werden die beta- und gamma-Phosphatgruppen gemeinsam übertragen, wobei AMP freigesetzt wird.
Bei all diesen Reaktionen wird ein relativ stabiles organisches Molekül in ein energiereicheres phosphoryliertes Produkt umgewandelt. Dieses aktivierte Produkt kann dann auf eine Weise weiterreagieren, die sein stabileres, nicht phosphoryliertes Gegenstück nicht könnte – Phosphorylgruppen sind, wie wir wissen, viel bessere Abgangsgruppen in nukleophilen Substitutionsreaktionen als die Hydroxylgruppe von Alkoholen. Obwohl die Umwandlung einer energieärmeren Ausgangsverbindung in ein energiereicheres Produkt an sich ein thermodynamisch ansteigender Prozess ist, ist die gesamte Phosphoryl-Transferreaktion thermodynamisch absteigend, weil die Umwandlung von ATP in ADP oder AMP – das Aufbrechen einer Phosphatanhydridbindung – sehr viel Energie freisetzt. Mit anderen Worten: Die in der Phosphatanhydridbindung von ATP gespeicherte Energie wurde „verbraucht“, um ein aktiviertes (energiereicheres) Molekül zu erzeugen. Wenn AMP oder ADP wieder in ATP umgewandelt wird, wird Energie von Brennstoffmolekülen (oder vom Sonnenlicht) benötigt, um die hochenergetische Anhydridbindung wieder zu bilden (dieser Prozess wird später in diesem Abschnitt besprochen)
Die Erklärung dafür, warum die Phosphatanhydridbindungen im ATP so energiereich sind, liegt vor allem im Konzept der Ladungstrennung. Erinnern Sie sich an Abschnitt 10.1, dass ATP bei einem physiologischen pH-Wert von ~7 fast vollständig ionisiert ist und eine Gesamtladung von fast -4 aufweist. Wenn eine der beiden Anhydridbindungen gebrochen wird, können sich die negativen Ladungen der Phosphatgruppen trennen, wodurch ein Teil der Abstoßung der gleichen Ladung, die im ATP vorhanden war, aufgehoben wird. Man kann sich das wie eine Spule vorstellen, die aufspringt.
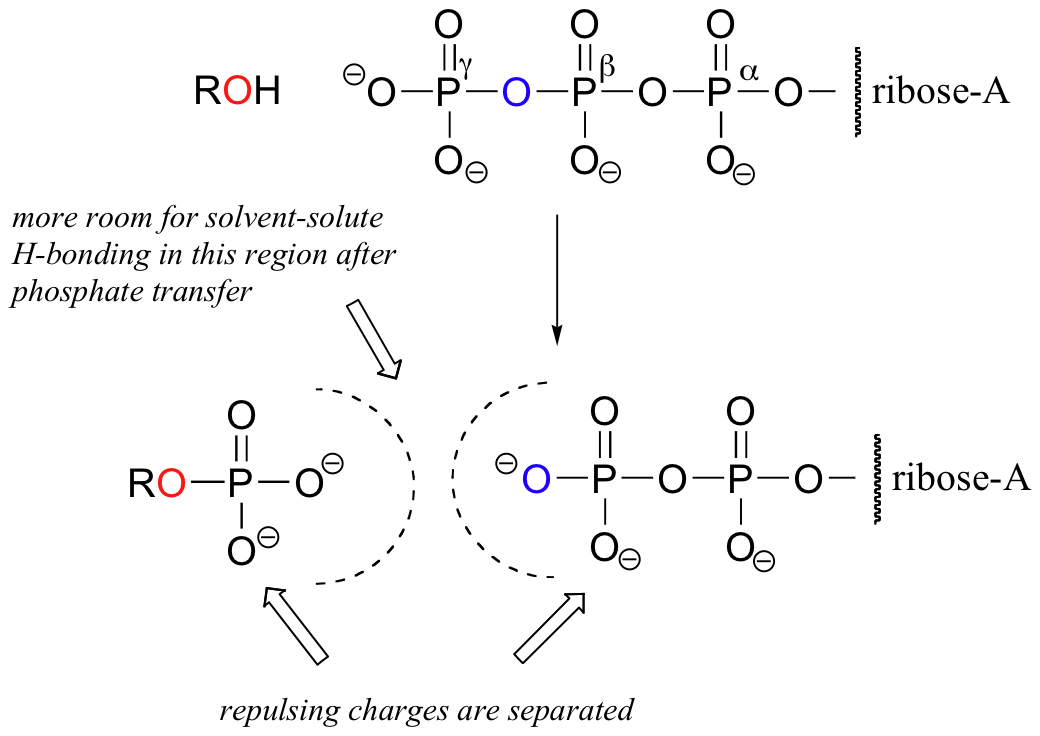
Ein weiterer Grund hat mit der Energie der Solvatation durch Wasser zu tun. Wenn das Gamma-Phosphat von ATP z. B. auf einen Alkohol übertragen wird, können die umgebenden Wassermoleküle mehr Wasserstoffbrückenbindungen mit den Produkten (ADP und das organische Phosphat) bilden, als dies bei ATP und Alkohol möglich war. Diese zusätzlichen Solvatationswechselwirkungen stabilisieren die Produkte der Phosphorylierungsreaktion relativ zu den Ausgangsverbindungen.
Sie werden mehr über die thermodynamische Rolle von ATP in den Stoffwechselwegen erfahren, wenn Sie einen Kurs in Biochemie belegen – was an dieser Stelle am wichtigsten zu verstehen ist, ist, dass ATP aufgrund der in seinen Phosphatanhydridbindungen gespeicherten Energie ein mächtiger Phosphorylgruppendonator ist und als solcher in vielen wichtigen biochemischen Reaktionen verwendet wird. Einige Beispiele werden im weiteren Verlauf dieses Abschnitts besprochen.