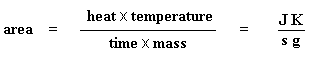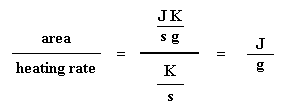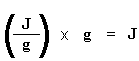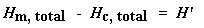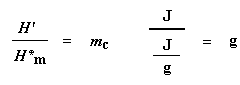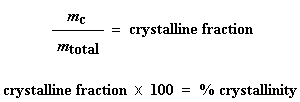Schlüsselwörter:
amorph,Kristall,Übergang erster Ordnung
Glasübergangstemperatur,Wärmekapazität,latente Wärme
Übergang zweiter Ordnung,thermischer Übergang
Wie kann man also untersuchen, was mit einem Polymer passiert, wenn man es erhitzt? Der erste Schritt wäre natürlich, es zu erhitzen. Und das tun wir in der Differential-Scanning-Kalorimetrie, kurz DSC.
Wir erhitzen unser Polymer in einem Gerät, das ungefähr so aussieht:
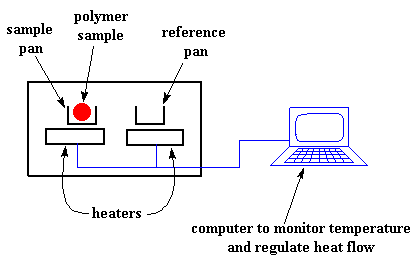
Aber noch wichtiger ist, dass er sicherstellt, dass die beiden separaten Pfannen mit ihren zwei separaten Heizungen mit der gleichen Geschwindigkeit erhitzt werden wie die jeweils andere.
Hm? Warum sollten sie sich nicht mit der gleichen Geschwindigkeit erwärmen? Der einfache Grund ist, dass die beiden Pfannen unterschiedlich sind. In einer ist Polymer drin, in der anderen nicht. Die Polymerprobe bedeutet, dass sich zusätzliches Material in der Probenschale befindet. Zusätzliches Material bedeutet, dass mehr Wärme benötigt wird, um die Temperatur der Probenschale mit der gleichen Rate ansteigen zu lassen wie die der Referenzschale.
Das Heizgerät unter der Probenschale muss also härter arbeiten als das Heizgerät unter der Referenzschale. Sie muss mehr Wärme abgeben. Wie viel mehr Wärme sie abgeben muss, messen wir in einem DSC-Experiment.
Genauer gesagt, machen wir Folgendes: Wir erstellen ein Diagramm, wenn die Temperatur steigt. Auf der x-Achse tragen wir die Temperatur ein. Auf der y-Achse wird der Unterschied in der Wärmeabgabe der beiden Heizer bei einer bestimmten Temperatur aufgetragen.
Wärmekapazität
Aus dieser Darstellung können wir eine Menge lernen. Stellen wir uns vor, wir erhitzen ein Polymer: Wenn wir beginnen, unsere beiden Pfannen zu erhitzen, wird der Computer die Differenz der Wärmeleistung der beiden Heizungen gegen die Temperatur auftragen. Das heißt, dass wir die vom Polymer absorbierte Wärme gegen die Temperatur auftragen. Der Plot wird zunächst etwa so aussehen.
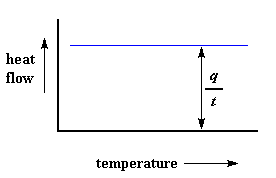
Der Wärmefluss bei einer bestimmten Temperatur kann uns etwas sagen. Der Wärmestrom wird in Einheiten von Wärme, q, die pro Zeiteinheit, t, geliefert wird, angegeben. Die Erwärmungsrate ist die Temperaturerhöhung T pro Zeiteinheit, t. Verstanden?
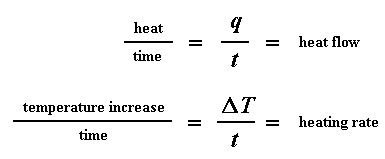
Sagen wir nun, dass wir den Wärmestrom q/t durch die Aufheizrate T/t teilen. Am Ende erhalten wir die zugeführte Wärme, geteilt durch die Temperaturerhöhung.
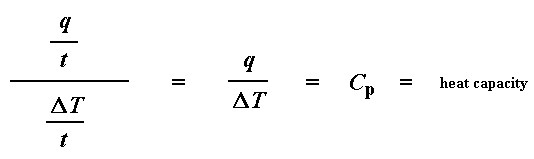
Erinnern Sie sich von der Glasübergangsseite, dass, wenn Sie eine bestimmte Wärmemenge in etwas einbringen, seine Temperatur um einen bestimmten Betrag ansteigt, und die Wärmemenge, die nötig ist, um einen bestimmten Temperaturanstieg zu erreichen, wird Wärmekapazität oder Cp genannt. Wir erhalten die Wärmekapazität, indem wir die zugeführte Wärme durch die resultierende Temperaturerhöhung dividieren. Und genau das haben wir in dieser Gleichung da oben getan. Wir haben die Wärmekapazität aus dem DSC-Diagramm errechnet.
Die Glasübergangstemperatur
Natürlich können wir mit der DSC viel mehr als nur die Wärmekapazität eines Polymers erfahren. Schauen wir uns an, was passiert, wenn wir das Polymer ein wenig mehr erhitzen. Ab einer bestimmten Temperatur wird sich unser Diagramm plötzlich nach oben verschieben, etwa so:
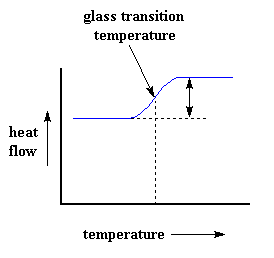
Das bedeutet, dass wir jetzt mehr Wärmefluss bekommen. Das bedeutet, wir haben auch eine Erhöhung der Wärmekapazität unseres Polymers. Dies geschieht, weil das Polymer gerade den Glasübergang durchlaufen hat. Und wie Sie auf der Seite über den Glasübergang gelernt haben, haben Polymere oberhalb der Glasübergangstemperatur eine höhere Wärmekapazität als unterhalb davon. Aufgrund dieser Änderung der Wärmekapazität, die beim Glasübergang auftritt, können wir die Glasübergangstemperatur eines Polymers mitDSC messen. Sie werden bemerken, dass die Änderung nicht plötzlich auftritt, sondern über einen Temperaturbereich erfolgt. Das macht die Auswahl einer diskreten Tg etwas schwierig, aber wir nehmen normalerweise einfach die Mitte der Steigung als Tg an.
Kristallisation
Aber warten Sie, es gibt noch mehr, so viel mehr. Oberhalb des Glasübergangs haben die Polymere eine Menge Beweglichkeit. Sie schlängeln und winden sich und bleiben nie sehr lange in einer Position. Sie sind wie Passagiere, die versuchen, es sich in den Sitzen einer Fluggesellschaft bequem zu machen, was ihnen nie ganz gelingt, weil sie sich mehr bewegen können. Wenn sie die richtige Temperatur erreichen, haben sie genug Energie gewonnen, um sich in sehr geordnete Anordnungen zu bewegen, die wir natürlich Kristalle nennen.
Wenn Polymere in diese kristallinen Anordnungen fallen, geben sie Wärme ab. Wenn diese Wärme abgeleitet wird, freut sich die kleine computergesteuerte Heizung unter der Probenschale. Sie ist glücklich, weil sie nicht viel Wärme abgeben muss, um die Temperatur der Probenschale aufrechtzuerhalten. Sie können diesen Abfall des Wärmestroms als große Einbuchtung im Diagramm des Wärmestroms gegenüber der Temperatur sehen:
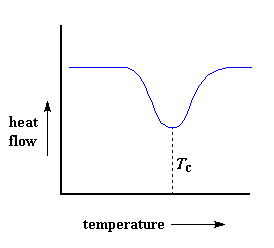
Diese Einbuchtung sagt uns eine Menge. Die Temperatur am tiefsten Punkt der Einbuchtung wird normalerweise als Kristallisationstemperatur des Polymers oder Tc angesehen. Außerdem können wir die Fläche der Einbuchtung messen, was uns die latente Energie der Kristallisation für das Polymer verrät. Aber am wichtigsten ist, dass diese Einbuchtung uns sagt, dass das Polymer tatsächlich kristallisieren kann. Wenn Sie ein 100 % amorphes Polymer, wie z. B. ataktisches Polystyrol, analysieren würden, würden Sie keine dieser Vertiefungen erhalten, da solche Materialien nicht kristallisieren.
Auch weil das Polymer Wärme abgibt, wenn es kristallisiert, nennen wir die Kristallisation einen exothermen Übergang.
Schmelzen
Wärme kann die Bildung von Kristallen in einem Polymer ermöglichen, aber zu viel davon kann ihr Verderben sein. Wenn wir unser Polymer weiter über seinen Tc-Wert hinaus erhitzen, erreichen wir schließlich einen anderen thermischen Übergang, der Schmelzen genannt wird. Wenn wir die Schmelztemperatur des Polymers, oder Tm, erreichen, beginnen diese Polymerkristalle auseinanderzufallen, das heißt, sie schmelzen. Die Ketten lösen sich aus ihrer geordneten Anordnung und beginnen, sich frei zu bewegen. Und falls Sie sich wundern, können wir dies auf einem DSC-Plot erkennen.
Erinnern Sie sich an die Wärme, die das Polymer beim Kristallisieren abgegeben hat? Nun, wenn wir die Tm erreichen, ist es Zeit für die Rückzahlung. Es gibt sowohl eine latente Schmelzwärme als auch eine latente Kristallisationswärme. Wenn die Polymerkristalle schmelzen, müssen sie Wärme aufnehmen, um dies zu tun. Denken Sie daran, dass Schmelzen ein Übergang erster Ordnung ist. Das bedeutet, dass die Temperatur des Polymers bei Erreichen der Schmelztemperatur nicht ansteigt, bis alle Kristalle geschmolzen sind. Das bedeutet, dass die kleine Heizung unter der Probenschale viel Wärme in das Polymer einbringen muss, um sowohl die Kristalle zu schmelzen als auch die Temperatur mit der gleichen Geschwindigkeit wie die der Referenzschale ansteigen zu lassen. Dieser zusätzliche Wärmefluss während des Schmelzens zeigt sich als großer Peak auf unserem DSC-Diagramm, etwa so:
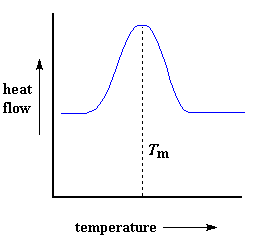
Wir können die latente Schmelzwärme messen, indem wir die Fläche dieses Peaks messen. Da wir dem Polymer Energie zuführen müssen, um es zum Schmelzen zu bringen, bezeichnen wir das Schmelzen als einen endothermen Übergang.
Alles zusammenfassen
Sehen wir also noch einmal zurück: Wir sahen eine Stufe im Diagramm, als das Polymer über seine Glasübergangstemperatur hinaus erhitzt wurde. Dann sahen wir einen großen Einbruch, als das Polymer seine Kristallisationstemperatur erreichte. Dann schließlich sahen wir eine große Spitze, als das Polymer seine Schmelztemperatur erreichte. Um alles zusammenzufassen, sieht ein Diagramm oft etwa so aus:
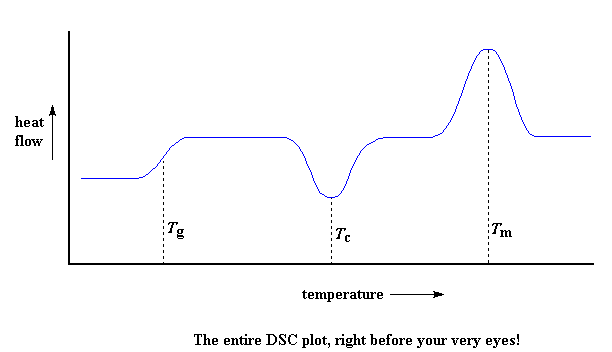
Natürlich ist nicht alles, was Sie hier sehen, in jedem DSC-Plot enthalten. Die Kristallisationstiefe und der Schmelzpeak werden nur bei Polymeren angezeigt, die Kristalle bilden können. Völlig amorphe Polymere zeigen keine Kristallisation und auch kein Schmelzen. Polymere, die sowohl kristalline als auch amorphe Domänen aufweisen, zeigen jedoch alle oben genannten Merkmale.
Wenn Sie sich das DSC-Diagramm ansehen, können Sie einen großen Unterschied zwischen dem Glasübergang und den beiden anderen thermischen Übergängen, Kristallisation und Schmelzen, erkennen. Für den Glasübergang gibt es keinen Dip, aber auch keinen Peak. Das liegt daran, dass das Polymer während des Glasübergangs keine latente Wärme abgibt oder aufnimmt. Das einzige, was wir bei der Glasübergangstemperatur sehen, ist eine Änderung der Wärmekapazität des Polymers.
Da es eine Änderung der Wärmekapazität gibt, aber keine latente Wärme am Glasübergang beteiligt ist, nennen wir den Glasübergang einen Übergang zweiter Ordnung. Übergänge wie Schmelzen und Kristallisation, die latente Wärme haben, nennt man Übergänge erster Ordnung.
Wie viel Kristallinität?
Die DSC kann uns auch sagen, wie viel eines Polymers kristallin und wie viel amorph ist. Wenn Sie die Seite über die Kristallinität von Polymeren gelesen haben, wissen Sie, dass viele Polymere sowohl amorphes als auch kristallines Material enthalten. Aber wie viel von beidem? Die DSC kann uns das sagen. Wenn wir die latente Schmelzwärme ΔHm kennen, können wir die Antwort herausfinden.
Das erste, was wir tun müssen, ist, die Fläche des großen Peaks zu messen, den wir für das Schmelzen des Polymers haben. Unser Diagramm ist ein Diagramm des Wärmestroms pro Gramm des Materials gegen die Temperatur. Der Wärmestrom ist die pro Sekunde abgegebene Wärme, also wird die Fläche des Peaks in den Einheiten Wärme x Temperatur x Zeit-1 x Masse-1 angegeben. Normalerweise würden wir dies in Einheiten wie Joule x Kelvin x (Sekunden)-1 x (Gramm)-1 angeben:
Kennen Sie das? Kein Problem. Es geht auch einfacher. Normalerweise teilen wir die Fläche durch die Heizrate unseres dsc-Experiments. Die Heizrate wird in Einheiten von K/s angegeben. So wird der Ausdruck einfacher: Nun haben wir eine Anzahl von Joule pro Gramm. Da wir aber die Masse der Probe kennen, können wir es uns einfacher machen. Wir multiplizieren dies einfach mit der Masse der Probe: Jetzt haben wir gerade die Gesamtwärme berechnet, die abgegeben wird, wenn das Polymer schmilzt.Toll, nicht wahr? Wenn wir nun die gleiche Berechnung für unseren Dip durchführen, die wir auf dem DSC-Plot für die Kristallisation des Polymers erhalten haben, können wir die gesamte während der Kristallisation absorbierte Wärme erhalten. Wir nennen die während des Schmelzens abgegebene Wärme Hm, gesamt, und wir nennen die Wärme der Kristallisation Hc, gesamt. Nun subtrahieren wir die beiden:
Warum haben wir das gerade gemacht? H‘ ist die Wärme, die von dem Teil der Polymerprobe abgegeben wird, der sich bereits im kristallinen Zustand befand, bevor wir das Polymer über die Tc erhitzt haben. Wir wollen wissen, wie viel des Polymers kristallin war, bevor wir mehr davon zum Kristallisieren gebracht haben, deshalb subtrahieren wir die bei der Kristallisation abgegebene Wärme. Können mir alle folgen? Nun können wir mit unserer magischen Zahl H‘ die prozentuale Kristallinität ausrechnen. Wir teilen sie durch die spezifische Schmelzwärme Hc*. Die spezifische Schmelzwärme? Das ist die Wärmemenge, die von einer bestimmten Menge, normalerweise einem Gramm, eines Polymers abgegeben wird. H‘ ist in Joule angegeben, und die spezifische Schmelzwärme wird normalerweise in Joule pro Gramm angegeben, so dass wir eine Antwort in Gramm erhalten, die wirmc nennen.
Das ist die Gesamtmenge an Gramm des Polymers, die unterhalb der Tc kristallin waren. Wenn wir nun diese Zahl durch das Gewicht unserer Probe, mGesamt, teilen, erhalten wir den Anteil der Probe, der kristallin war, und dann natürlich die prozentuale Kristallinität: Und so verwenden wir DSC, um die prozentuale Kristallinität zu erhalten.
Zurück zum Verzeichnis der Ebene Fünf
Zurück zum Macrogalleria-Verzeichnis