 Das Periodensystem ist wie ein großes Gitter organisiert. Jedes Element ist aufgrund seiner atomaren Struktur an einer bestimmten Stelle platziert. Wie jedes Gitter hat auch das Periodensystem Zeilen (von links nach rechts) und Spalten (nach oben und unten). Jede Zeile und Spalte hat bestimmte Eigenschaften. Zum Beispiel befinden sich Magnesium (Mg) und Kalzium (Mg) in Spalte zwei und haben bestimmte Gemeinsamkeiten, während Kalium (K) und Kalzium (Ca) aus Reihe vier andere Eigenschaften haben. Magnesium und Natrium (Na) haben ebenfalls gemeinsame Eigenschaften, da sie sich in der gleichen Periode befinden (ähnliche Elektronenkonfigurationen).
Das Periodensystem ist wie ein großes Gitter organisiert. Jedes Element ist aufgrund seiner atomaren Struktur an einer bestimmten Stelle platziert. Wie jedes Gitter hat auch das Periodensystem Zeilen (von links nach rechts) und Spalten (nach oben und unten). Jede Zeile und Spalte hat bestimmte Eigenschaften. Zum Beispiel befinden sich Magnesium (Mg) und Kalzium (Mg) in Spalte zwei und haben bestimmte Gemeinsamkeiten, während Kalium (K) und Kalzium (Ca) aus Reihe vier andere Eigenschaften haben. Magnesium und Natrium (Na) haben ebenfalls gemeinsame Eigenschaften, da sie sich in der gleichen Periode befinden (ähnliche Elektronenkonfigurationen). 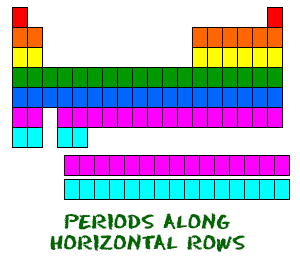 Auch wenn sie einige Quadrate dazwischen überspringen, lesen sich alle Reihen von links nach rechts. Wenn Sie sich das Periodensystem ansehen, wird jede Zeile als Periode bezeichnet (Verstehen Sie? Wie PERIODentabelle.). Alle Elemente in einer Periode haben die gleiche Anzahl von Atomorbitalen. Zum Beispiel hat jedes Element in der obersten Reihe (der ersten Periode) ein Orbital für seine Elektronen. Alle Elemente in der zweiten Reihe (der zweiten Periode) haben zwei Orbitale für ihre Elektronen. Wenn Sie sich in der Tabelle nach unten bewegen, wird in jeder Reihe ein Orbital hinzugefügt. Zu diesem Zeitpunkt gibt es ein Maximum von sieben Elektronenorbitalen.
Auch wenn sie einige Quadrate dazwischen überspringen, lesen sich alle Reihen von links nach rechts. Wenn Sie sich das Periodensystem ansehen, wird jede Zeile als Periode bezeichnet (Verstehen Sie? Wie PERIODentabelle.). Alle Elemente in einer Periode haben die gleiche Anzahl von Atomorbitalen. Zum Beispiel hat jedes Element in der obersten Reihe (der ersten Periode) ein Orbital für seine Elektronen. Alle Elemente in der zweiten Reihe (der zweiten Periode) haben zwei Orbitale für ihre Elektronen. Wenn Sie sich in der Tabelle nach unten bewegen, wird in jeder Reihe ein Orbital hinzugefügt. Zu diesem Zeitpunkt gibt es ein Maximum von sieben Elektronenorbitalen.
…und Ihre Gruppen
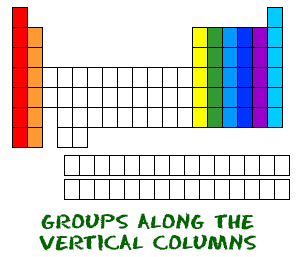 Nun wissen Sie, dass die Perioden von links nach rechts gehen. Das Periodensystem hat auch einen speziellen Namen für seine vertikalen Spalten. Jede Spalte wird eine Gruppe genannt. Die Elemente in jeder Gruppe haben die gleiche Anzahl von Elektronen im äußeren Orbital. Diese Außenelektronen werden auch Valenzelektronen genannt. Sie sind die Elektronen, die an chemischen Bindungen mit anderen Elementen beteiligt sind.
Nun wissen Sie, dass die Perioden von links nach rechts gehen. Das Periodensystem hat auch einen speziellen Namen für seine vertikalen Spalten. Jede Spalte wird eine Gruppe genannt. Die Elemente in jeder Gruppe haben die gleiche Anzahl von Elektronen im äußeren Orbital. Diese Außenelektronen werden auch Valenzelektronen genannt. Sie sind die Elektronen, die an chemischen Bindungen mit anderen Elementen beteiligt sind.
Jedes Element in der ersten Spalte (Gruppe eins) hat ein Elektron in seiner Außenschale. Jedes Element in der zweiten Spalte (Gruppe zwei) hat zwei Elektronen in der äußeren Schale. Wenn Sie die Spalten weiterzählen, wissen Sie, wie viele Elektronen sich in der äußeren Schale befinden. Es gibt Ausnahmen von der Reihenfolge, wenn Sie sich die Übergangselemente ansehen, aber Sie bekommen die allgemeine Idee. Übergangselemente fügen dem vorletzten Orbital Elektronen hinzu.
Zum Beispiel hat Stickstoff (N) die Ordnungszahl sieben. Die Ordnungszahl sagt Ihnen, dass sich in einem neutralen Stickstoffatom sieben Elektronen befinden. Wie viele Elektronen befinden sich in seinem äußeren Orbital? Stickstoff befindet sich in der fünfzehnten Spalte, beschriftet mit „Gruppe VA“. Das „V“ ist die römische Zahl für fünf und steht für die Anzahl der Elektronen im äußeren Orbital. Anhand dieser Informationen wissen Sie, dass sich im ersten Orbital zwei Elektronen und im zweiten Orbital fünf Elektronen befinden (2-5).
Phosphor (P) ist ebenfalls in der Gruppe VA, was bedeutet, dass es ebenfalls fünf Elektronen in seinem äußeren Orbital hat. Da die Ordnungszahl für Phosphor jedoch fünfzehn ist, ist die Elektronenkonfiguration 2-8-5.
Zwei an der Spitze
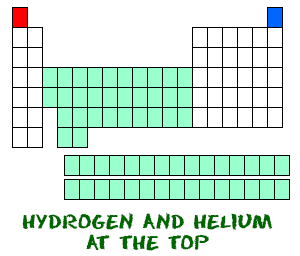 Wasserstoff (H) und Helium (He) sind besondere Elemente. Wasserstoff, in seiner neutralen Form, hat kein Neutron. Es gibt nur ein Elektron und ein Proton. Sie werden wahrscheinlich keine atomaren Wasserstoffe finden, die alleine herumschwimmen. Atomarer Wasserstoff will sich mit anderen Elementen verbinden, um seine äußere Schale zu füllen. In Ihrer Chemiearbeit werden Sie höchstwahrscheinlich molekularen Wasserstoff (H2) oder Wasserstoff-Ionen (H+, Protonen) verwenden.
Wasserstoff (H) und Helium (He) sind besondere Elemente. Wasserstoff, in seiner neutralen Form, hat kein Neutron. Es gibt nur ein Elektron und ein Proton. Sie werden wahrscheinlich keine atomaren Wasserstoffe finden, die alleine herumschwimmen. Atomarer Wasserstoff will sich mit anderen Elementen verbinden, um seine äußere Schale zu füllen. In Ihrer Chemiearbeit werden Sie höchstwahrscheinlich molekularen Wasserstoff (H2) oder Wasserstoff-Ionen (H+, Protonen) verwenden.
Helium (He) unterscheidet sich von allen anderen Elementen. Es ist sehr stabil mit nur zwei Elektronen in seinem äußeren Orbital (Valenzschale). Obwohl es nur zwei Elektronen hat, wird es zu den Edelgasen gezählt, die acht Elektronen in ihren äußersten Orbitalen haben. Die Edelgase und Helium sind alle „glücklich“, weil ihre Valenzschale voll ist.
Verwandte Videos…
Wikipedia: Periodensystem
Encyclopedia.com: Periodensystem