

Niels Bohr veränderte unsere Sicht auf das Atom und auf die Welt völlig. Er erkannte, dass die klassische Physik katastrophal versagt, wenn die Dinge atomgroß oder kleiner sind, und baute das Atom so um, dass die Elektronen „erlaubte“ Bahnen um den Kern besetzten, während alle anderen Bahnen verboten waren. Auf diese Weise begründete er die Quantenmechanik.
Später, als führender Architekt der Kopenhagener Interpretation der Quantenmechanik, half er, unser Verständnis davon, wie die Natur auf der atomaren Skala funktioniert, neu zu gestalten.
Anfänge
Niels Henrik David Bohr wurde am 7. Oktober 1885 in Dänemarks Hauptstadt Kopenhagen geboren. Er war das zweite von drei Kindern einer wohlhabenden, großbürgerlichen Familie.
Sein Vater war Christian Bohr, ein brillanter Physiologieprofessor, der später zweimal für den Nobelpreis nominiert wurde. Seine Mutter war Ellen Adler, Tochter eines wohlhabenden dänischen Politikers.
Der Vater war in einer lutherischen Familie aufgewachsen, die Mutter in einer jüdischen Familie. Niels ließ sich im Alter von sechs Jahren lutherisch taufen, um einer seiner Großmütter zu gefallen. Weder sein Vater noch seine Mutter praktizierten ihre Religionen.
Niels‘ Eltern legten großen Wert auf die Erziehung ihrer Kinder. Niels wurde zu Hause unterrichtet, bis er im Alter von 7 Jahren die formale Schulausbildung am Gammelholm-Gymnasium begann. Die Schule war sowohl eine Grund- als auch eine Oberschule. Sie hatte eine strenge Disziplin und erwartete von ihren Schülern, dass sie hart arbeiten.
Sein Vater brachte verschiedene Professoren-Kollegen von der Universität Kopenhagen mit nach Hause, und die Bohr-Kinder durften den Gesprächen lauschen, die weit gefächert waren und sich mit Wissenschaft, Philosophie und Kunst befassten.
Körperliche und intellektuelle Stärke
Niels war in den meisten Schulfächern gut, aber in seiner eigenen Muttersprache, dem Dänischen, war er eher schwach. Während er gerne redete, hatte er eine gründliche Abneigung gegen das Schreiben von Aufsätzen. Von Natur aus mathematisch begabt, zog es ihn zunehmend zu den Naturwissenschaften.
Physik interessierte Niels besonders, und als er ein Teenager war, korrigierte er die Fehler in den Lehrbüchern seiner Schulen. Neben seinem intellektuellen Elan war er auch körperlich ungewöhnlich stark. Er korrigierte nicht nur Lehrbücher, sondern „korrigierte“ auch andere Schüler, indem er sich in der Schule prügelte, was er in der Regel gewann.
Obwohl er schließlich einer der größten theoretischen Physiker der Welt werden sollte, war er auch praktisch mit seinen Händen begabt. Er und sein jüngerer Bruder verbrachten Stunden damit, in der Werkstatt ihres Vaters Dinge herzustellen.
Sein Vater sah, dass Niels das Potenzial hatte, ein herausragender Wissenschaftler zu werden. Allerdings wollten beide Elternteile von Niels nicht, dass ihr Sohn mit engstirnigen Interessen aufwuchs. Sie sorgten dafür, dass er kulturell und sportlich gut ausgebildet wurde.
Sein Vater begeisterte sich besonders für die Werke des deutschen Schriftstellers Goethe und rezitierte seinen Kindern regelmäßig große Teile des Faust. Sein Vater liebte auch Fußball und ermutigte seine Söhne, in der Schule und an der Universität zu spielen. Niels wurde Torwart, während sein jüngerer Bruder Harald für Dänemark spielte und eine olympische Silbermedaille gewann.

Links: Christian Bohr. Rechts: (von links nach rechts): Mutter und Kinder. Alle drei Bohr-Kinder wurden Absolventen der Universität von Kopenhagen. Jenny wurde Lehrerin für Geschichte und Dänisch. Harald wurde ein berühmter Mathematiker.
B.S. Degree and Some Remarkable Research Work
Im Jahr 1903, im Alter von 17 Jahren, machte Niels sein Abitur. Noch im selben Jahr begann er sein Studium an der Universität von Kopenhagen. Er studierte Astronomie, Chemie, Mathematik und Physik als Hauptfach.
Im Februar 1905, während er auf seinen Abschluss hinarbeitete, kündigte die Königlich Dänische Akademie der Wissenschaften an, dass eine Goldmedaille für die beste Forschungsarbeit über Methoden zur Messung der Oberflächenspannung von Flüssigkeiten vergeben werden würde. Dieser Preis war für erfahrene Wissenschaftler gedacht, nicht für Studenten. Niels war sich seiner eigenen wachsenden Stärke in der Physik bewusst und er war ehrgeizig; er beschloss, an dem Wettbewerb teilzunehmen.
Er hatte das Glück, einen Professor als Vater zu haben. Sein Vater erlaubte ihm in seinem Physiologielabor Platz für Experimente. Monatelang arbeitete Niels allein und wie besessen in der Nacht, baute seine eigene Ausrüstung und benutzte sie, um Wasserstrahlen zu formen und Messungen durchzuführen.
Sein Vater, der die wachsende Besessenheit seines Sohnes von den Experimenten erkannte, befahl ihm, damit aufzuhören und seine Forschungen aufzuschreiben. Dazu zog sich Niels auf den Landsitz seiner wohlhabenden Großeltern mütterlicherseits zurück. Die Arbeit, die er Ende Oktober 1906 einreichte, war so brillant, dass sie ihm eine Goldmedaille einbrachte – eine bemerkenswerte Leistung für einen Undergraduate. Er teilte sich den Preis mit dem elf Jahre älteren Peder Pedersen, der bald Professor für Elektrotechnik werden sollte.
Niels Bohr schloss sein Studium 1907 mit einem Bachelor of Science ab.
M.S. und Ph.D.
In den Jahren 1907 bis 1911 absolvierte Bohr seinen M.S.- und Ph.D.-Abschluss in Physik. In beiden Fällen befasste er sich mit der Elektronentheorie der Metalle. Sein Doktortitel,
Die Physik explodiert
Bohrs Eintritt in die Physik fällt in eine besonders spannende Zeit.
- Im Jahr 1897, als Bohr 12 Jahre alt war, entdeckte J. J. Thomson das Elektron.
- 1898 entdeckte Ernest Rutherford die von Uran emittierten Alpha- und Betateilchen.
- Im Jahr 1905, als Bohr seine mit der Goldmedaille ausgezeichnete Forschung begann, entfesselte Albert Einstein in seinem Wunderjahr eine Flut neuer Ideen und schrieb vier weltverändernde Arbeiten über: Brownsche Bewegung, die Äquivalenz von Masse und Energie, den photoelektrischen Effekt und die spezielle Relativitätstheorie.
- Im Jahr 1909 entdeckte Ernest Rutherford den Atomkern.
Ein schlechter Start bei J. J. Thomson
Bohr erhielt ein Stipendium für ein Postdoc-Jahr in Übersee und hatte das Glück, als einer der wenigen Auserwählten in J. J. Thomsons Cavendish Laboratory an der Universität Cambridge in England zu arbeiten. Er kam im Oktober 1911 an.
Bohr, damals 26 Jahre alt, erwischte bei Thomson einen schlechten Start. Mit einem unerhörten Mangel an Subtilität war das erste, was der junge Physiker zu dem großen Mann sagte, „das ist falsch“ und zeigte auf eine Seite eines von Thomson verfassten Buches. Vielleicht hatte diese unglückliche erste Begegnung etwas damit zu tun, aber Bohr tat sich schwer mit den Arbeiten des Cavendish Labs. Die Forschung reizte ihn nicht.
Ernest Rutherford – Es geht aufwärts
Ende 1911 lernte Bohr einen anderen großen Physiker kennen, Ernest Rutherford, dessen Labor an der Universität von Manchester war. Er fragte Rutherford, ob er dorthin wechseln könne, um mit ihm zu arbeiten. Rutherford sagte ja, vorausgesetzt, Bohr holte sich vorher Thomsons Zustimmung.
Und so fuhr Bohr im März 1912 mit dem Zug nach Manchester, um mit dem Mann zu arbeiten, der ihn sowohl inspirieren als auch zu einem seiner besten Freunde werden sollte.
Rutherford hatte 1908 den Chemie-Nobelpreis für seine Arbeiten über Radioaktivität erhalten. Im Jahr 1909 hatte er den Atomkern entdeckt. Doch trotz Rutherfords hohem Ansehen war seine Behauptung, das Atom bestehe aus einem winzigen, sehr dichten, positiv geladenen Kern, der von negativ geladenen Elektronen umgeben sei, bei anderen Physikern auf wenig Gegenliebe gestoßen.
Bohr interessierte sich zunehmend für Rutherfords Modell des Atoms, insbesondere für das Verhalten der Elektronen, das Thema seiner Doktorarbeit.
Er und Rutherford wurden die besten Freunde, und in den kommenden Jahren verbrachten sie und ihre Frauen glückliche Urlaube miteinander. 25 Jahre nach ihrer ersten Zusammenarbeit nahm Bohr mit Rutherfords Familie an der Beerdigung des großen Mannes teil.
Große Ideen
Bohr kehrte im Herbst 1912 nach Dänemark zurück und hatte vor allem zwei Ideen:
Erstens wollte er das Verhalten der Elektronen im Atom verstehen.
Zweitens beschloss er, sein eigenes Verhalten als Physiker an dem von Rutherford zu orientieren. Bohr fand Rutherfords grenzenlose Energie, seine Begeisterung und sein Wissen inspirierend. Auch die intellektuell anregende Atmosphäre in der Rutherford-Gruppe hatte er als sehr angenehm empfunden. Er hoffte, eines Tages eine ebenso hervorragende Forschungsgruppe in Kopenhagen aufbauen zu können.
Niels Bohrs Beiträge zur Wissenschaft
Bohr sicherte sich nach seiner Rückkehr an die Universität Kopenhagen einen Lehrauftrag.
In der Zwischenzeit konzentrierte sich seine Forschung in der theoretischen Physik auf das Verständnis des Platzes des Elektrons im Atom.
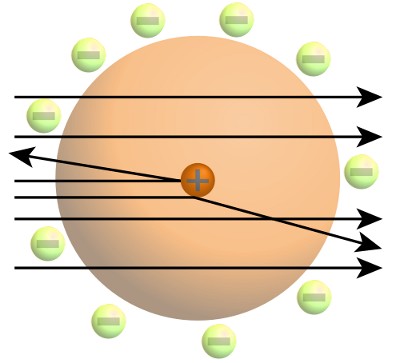
Rutherfords Arbeit hatte gezeigt, dass Atome aus einem winzigen, dichten, positiv geladenen Kern bestehen. Der größte Teil des Volumens eines Atoms war leerer Raum, der in irgendeiner Weise von negativ geladenen Elektronen patrouilliert wurde.
Bohr wusste, dass Rutherfords Bild des Atoms nicht mit den Gesetzen der klassischen Physik vereinbar war. Diese besagten, dass negativ geladene Elektronen Energie abstrahlen und in den positiv geladenen Kern hineingezogen werden müssen. Schon in seiner Doktorarbeit stellte Bohr fest, dass es für die klassische Physik unmöglich war, das Verhalten auf der atomaren Skala zu erklären.
Nun suchte er in der neuen Quantenphysik von Max Planck und Albert Einstein nach einer Lösung für das scheinbar unmögliche Verhalten der Elektronen. Tatsächlich begann er auf dieser Spur 1912 in Manchester.
Die Quantenphysik hatte festgestellt, dass, wenn ein Objekt Wärme- oder Lichtwellen ausstrahlt, die Emission nicht in einem kontinuierlichen Strom erfolgt, sondern in einzelnen Paketen von Wellenenergie.
Einstein nannte diese einzelnen Pakete Photonen. Wie alle Wellen haben auch Photonen eine Geschwindigkeit, eine Frequenz und eine Wellenlänge.
Planck folgerte, dass die Energiemenge, die ein Photon transportiert, durch die Multiplikation von nur zwei Zahlen ermittelt werden kann. Das waren die Frequenz des Lichts und eine Zahl, die wir heute die Planck-Konstante nennen. Seine Gleichung lautet E = hf, wobei E die Energie, h die Planck-Konstante und f die Frequenz ist.
Ein Photon konnte also nur eine Energiemenge tragen, die ein Vielfaches einer Zahl war – der Planckschen Konstante. Alle anderen Energien waren verboten. Das war die Essenz der Quantentheorie – Licht durfte bestimmte Energiemengen haben, aber andere waren verboten.
So sehr Bohr auch arbeitete, so viel Literatur er auch las und so sehr er das Problem auch mit Kollegen diskutierte, er konnte keinen Weg finden, die Quantentheorie – also erlaubte und verbotene Zustände – in das Verhalten des Elektrons im Atom einzubringen.
Dann, im Februar 1913, kam der Durchbruch. Er hörte von der Balmer-Serie und der Balmer-Formel.

Teil der Balmer-Serie. Diese Lichtfarben werden von Wasserstoff bei hohen Temperaturen emittiert. Die Wellenlänge und die Frequenz der verschiedenen Lichtfarben lassen sich in eine Formel einpassen – die Balmer-Formel.
Im Jahr 1885 war der Schweizer Mathematiker Johann Balmer auf eine mathematische Formel gestoßen, die die Wellenlängen – und damit die Farben – des von heißem Wasserstoff ausgesandten Lichts vorhersagte. Es gab keine theoretische Grundlage für diese Formel. Sie funktionierte einfach!
Nun spürte Bohr, dass er wirklich an etwas dran war. Er nahm Balmers Formel und nutzte die neue Quantentheorie, um zu zeigen, warum sie funktionierte. Damit wurde er zum Vater der Quantenmechanik – der Physik der Objekte im atomaren Maßstab.
Bohr schlug vor, dass die Beziehung E = hf der Kern der Erklärung für das Verhalten von Elektronen ist. So wie die Lichtenergie in bestimmten Energiepaketen auftritt, so auch die Elektronen. Nur bestimmte Werte der Elektronenenergie waren erlaubt, und diese konnten für Wasserstoff mit Hilfe der Balmerschen Formel berechnet werden.
In die Balmersche Formel setzte Bohr die Plancksche Formel und einige andere wichtige Zahlen ein, darunter die Masse des Elektrons und seine Ladung.
Das mathematische Ergebnis war, vereinfacht ausgedrückt, ein Atom, das man sich als ein winziges Sonnensystem vorstellen kann. So wie die Planeten die Sonne umkreisen, umkreisen die Elektronen den Atomkern in festen Bahnen. Je weiter ein Elektron vom Kern entfernt ist, desto höher ist seine Energie. Anders als bei Planeten können sich mehrere Elektronen eine Umlaufbahn um den Kern teilen.
Bohr wirft neues Licht auf ein altes Problem
Wissenschaftler hatten sich lange gefragt, wie genau Materie Licht absorbieren und aussenden kann. Bohrs neues Modell des Atoms bot die Erklärung.
Bohr sagte, dass Elektronen auf bestimmte kreisförmige Bahnen beschränkt sind, aber von einer Bahn mit niedrigerer Energie auf eine Bahn mit höherer Energie springen können, indem sie Licht absorbieren. Sie können auch das Gegenteil tun und von einer Bahn mit höherer Energie auf eine Bahn mit niedrigerer Energie fallen, indem sie Licht emittieren – wie im Bild unten gezeigt.
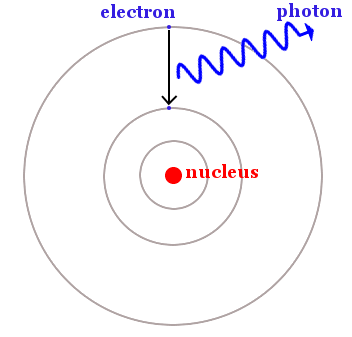
Ein Elektron fällt von einer Bahn mit höherer Energie auf eine Bahn mit niedrigerer Energie. Dabei wird Energie in Form eines Lichtphotons freigesetzt. Die Energiedifferenz zwischen den Bahnen entspricht der Energie des Photons, die mit der Planckschen Gleichung E = hf berechnet werden kann.
In der klassischen Physik konnten Elektronen jede Energie haben. In der neuen Quantenphysik wurden die Elektronen auf definierte Bahnen mit fester Energie beschränkt. Andere Elektronenenergien waren verboten.
Wenn ein Elektron Energie aufnahm, machte es einen Quantensprung, verschwand aus einem Orbit und erschien in einem höheren über eine verbotene Energiezone. Wenn ein Elektron Energie verlor, verschwand es aus einer Bahn mit höherer Energie und erschien in einer Bahn mit niedrigerer Energie, die durch eine verbotene Zone getrennt war.
Die Quantentheorie „erklärte“, warum Elektronen ihre Energie nicht abstrahlen, wenn sie in den Kern fallen, weil dieser Prozess verboten ist: Der Kern ist keine erlaubte Energiebahn für ein Elektron.
Die Quantentheorie erklärte auch die Spektren von Atomen und zeigte, dass die intensiven Farben in den Spektren mit den Energien der Elektronenbahnen in den Atomen zusammenhängen.

Das Emissionsspektrum von Helium. Die intensiven Linien verraten die Energien der erlaubten Elektronenbahnen im Helium.
Die Begründung der Quantenchemie
Bohr zeigte, dass die chemischen Eigenschaften der Elemente hauptsächlich aus dem Verhalten der Elektronen resultieren, die die höchste stabile Bahn besetzen – diese werden Valenzelektronen genannt. Damit erklärte er einen Großteil des Aufbaus des Periodensystems und begründete eine neue wissenschaftliche Disziplin – die Quantenchemie.
Bohr bringt unser Verständnis des Atoms mit einem Quantensprung voran
Im Jahr 1912 hatten viele Wissenschaftler noch nicht einmal das Modell von Rutherford übernommen. 1913 kombinierte Bohr die Mathematik mit seiner starken physikalischen Intuition und stellte fest, dass die Elektronen den Atomkern auf definierten Bahnen umkreisen. Das Rutherford-Bohr-Modell des Atoms wird bis heute in den Gymnasien gelehrt.
Bohr öffnete das Atom für die Quantentheorie: Es war ein Objekt, das seinen Zustand nicht fließend, sondern schrittweise veränderte.
Allerdings funktionierte seine Theorie nur für Atome mit einem Elektron – also Wasserstoff oder ionisiertes Helium – gut. Dennoch war Bohrs der entscheidende Schritt – er öffnete die Tür. Bald stand die Quantenwelt knietief in fleißigen Physikern, die eifrig ihre bizarren Ecken und Winkel erforschten.
 „Das ganze Arbeitsfeld ist in der Tat aus einem sehr einsamen Zustand plötzlich in einen verzweifelt überfüllten geraten, in dem fast jeder hart zu arbeiten scheint.“
„Das ganze Arbeitsfeld ist in der Tat aus einem sehr einsamen Zustand plötzlich in einen verzweifelt überfüllten geraten, in dem fast jeder hart zu arbeiten scheint.“
In den 1920er Jahren lieferten Werner Heisenberg und Erwin Schrödinger eine wesentlich verbesserte Quantensicht auf den Platz des Elektrons im Atom.
Bohr ist gefragt
Bohr veröffentlichte 1913 drei berühmte Quantenpapiere. Damit erlebte sein Ruf als Physiker seinen ganz eigenen Quantensprung. Er gab Seminare an der Universität Göttingen – dem Zentrum des mathematischen Universums – und nahm ein Angebot von Ernest Rutherford an, in einer leitenden akademischen Forschungsfunktion nach Manchester zurückzukehren.
Der Ausbruch des 1. Weltkriegs erschwerte die Situation, aber Bohr arbeitete von 1914 bis 1916 in Manchester.
Danach kehrte er nach Kopenhagen zurück, um an der Universität den ersten Lehrstuhl für theoretische Physik zu übernehmen. Er sammelte Geld, um ein Forschungsinstitut für theoretische Physik als Teil der Universität zu gründen, nach dem Vorbild von Rutherfords Forschungsgruppe. Werner Heisenberg und einige andere Architekten der neuen Quantenmechanik entwickelten ihre Ideen in Kopenhagen unter Bohrs Leitung.
Heute arbeitet das Niels-Bohr-Institut weiterhin an der Spitze der physikalischen Wissenschaften.
Nobelpreis
Bohr wurde 1922 für seine Arbeit mit dem Nobelpreis für Physik ausgezeichnet.
Die Kopenhagener Interpretation der Quantenmechanik
Als sich die Quantenmechanik entwickelte, entstanden unterschiedliche Ansichten, wie sie zu interpretieren sei. Es gab einen großen intellektuellen Disput (immer eher gutmütig als erbittert) zwischen Einstein und Bohr darüber, ob, um Einstein zu paraphrasieren, Gott mit dem Universum würfelt. Einstein sagte nein, Bohr sagte ja.

Bohr und Einstein genossen die Gesellschaft des anderen und waren sich in vielen Dingen einig, aber sie konnten sich nicht über die Quantenwelt einigen.
Heute akzeptiert die große Mehrheit der Physiker Bohrs These, dass Gott tatsächlich mit dem Universum würfelt.
Auf der atomaren Skala kann die Welt für jeden, der hofft, sie nach den Gesetzen des „gesunden Menschenverstands“ oder gar den Regeln der klassischen Physik zu interpretieren, befremdlich aussehen. Es ist eine Welt, in der sich etwas, das wir normalerweise für eine Welle halten, wie zum Beispiel Licht, wie ein Teilchen verhalten kann. Oder etwas, das wir normalerweise für ein Teilchen halten, wie z. B. ein Elektron, kann sich wie eine Welle verhalten. Ein einzelnes Neutron kann an zwei Orten gleichzeitig zu sein scheinen, die nur wenige Zentimeter voneinander entfernt sind. Es ist eine Welt, in der man sich eine Katze gleichzeitig als lebendig und tot (oder in einem Zwischenzustand) vorstellen kann.
Drei der Giganten der Physik des 20. Jahrhunderts – Niels Bohr, Werner Heisenberg und Wolfgang Pauli – waren die Schlüsselfiguren bei der Entwicklung dessen, was als Kopenhagener Interpretation der Quantenmechanik bekannt wurde. Pauli musste zwischen Bohr und Heisenberg (der in Bohrs Institut arbeitete) vermitteln, weil sie zeitweise so heftig darüber stritten, wie die Quantenwelt zu interpretieren sei, dass sie kaum miteinander sprechen konnten.
Aus diesem glühenden intellektuellen Schmelztiegel gingen vier der wichtigsten Ideen der so genannten Kopenhagener Interpretation der Quantentheorie hervor. Diese waren:
- Bohrs Prinzip der Komplementarität/Heisenbergs Unschärferelation
- Wellen-Teilchen-Dualismus
- Interpretation von Wellen-Funktionen mit Hilfe von Wahrscheinlichkeiten
- Das Korrespondenzprinzip – die Verschmelzung der Quantenmechanik mit der klassischen Mechanik bei größeren Quantenzahlen
Was auch immer die philosophischen Implikationen der Kopenhagener Interpretation sein mögen – und davon gibt es viele – zum Beispiel, dass die Realität nicht existiert, wenn man nicht danach sucht -, was wir sicher wissen, ist, dass die Methoden der Quantenmechanik in der Praxis funktionieren.
Die Quantenmechanik ist das mächtigste Werkzeug, das wir je hatten, um herauszufinden, wie das Universum auf der atomaren Skala funktioniert.
Der zusammengesetzte Kern
Mit James Chadwicks Entdeckung des Neutrons in Rutherfords Labor 1932 wandte Bohr seine Aufmerksamkeit dem Atomkern zu.
Kernreaktionen faszinierten ihn, insbesondere Reaktionen, bei denen Atomkerne mit Neutronen beschossen wurden, um neue, radioaktive Kerne zu bilden – Neutroneneinfangreaktionen.
Unzufrieden mit den Versuchen anderer Physiker, den Neutroneneinfang zu erklären, formulierte Bohr in den Jahren 1934 und 1935 die Theorie der zusammengesetzten Kerne und veröffentlichte sie 1936. Seine Idee war, dass ein Neutron, wenn es in einen Kern eindringt, wiederholt mit einer großen Anzahl von vorhandenen Neutronen und Protonen kollidiert, nicht nur mit einem von ihnen. Das Ergebnis ist ein halbstabiler Verbundkern. Dieser Kern befindet sich durch die Kollisionen in einem hochenergetischen Zustand und verliert diese Energie auf unterschiedliche Weise, z. B. indem er ein Neutron verliert oder Gammastrahlen aussendet.
Bohrs Theorie stand für die folgenden zwei Jahrzehnte im Mittelpunkt, bis in den 1950er Jahren sein Sohn Aage eine Schlüsselrolle bei der Formulierung eines verbesserten Modells des Kerns und der Kernreaktionen spielte.
Der Kern als Flüssigkeitstropfen
Im Jahr 1939 erarbeiteten Niels Bohr und John Archibald Wheeler gemeinsam das Flüssigkeitstropfen-Modell. Dieses Modell stellte den Kern als einen rotierenden Tropfen einer inkompressiblen Flüssigkeit dar, der durch Oberflächenspannung zusammengehalten wird.
Ein Flüssigkeitstropfen kann aus seiner kugelförmigen Grundform verformt werden und ein großer Flüssigkeitstropfen kann in zwei neue Tropfen auseinanderfallen. In ähnlicher Weise kann ein großer Atomkern, wie Uran, auseinanderfallen und zwei neue Atomkerne bilden – das ist die Kernspaltung, die Energiequelle hinter der Uran-Atombombe und dem Uran-Kraftwerk.

Der winzige Atomkern wurde als Flüssigkeitstropfen modelliert, der durch Oberflächenspannung zusammengehalten wird. Genau wie eine Flüssigkeit war die Form des Tropfens kugelförmig, konnte aber aus dieser Form heraus verformt werden.
Das Modell des flüssigen Tropfens hatte seine größten Erfolge bei der Erklärung der Eigenschaften schwerer Kerne, wie z. B. Uran.
Das Manhattan-Projekt
Im April 1940 wurde Dänemark von der Wehrmacht Nazi-Deutschlands überfallen. Bohrs Mutter war Jüdin, was für ihn Probleme bedeuten konnte. Zunächst gab es zum Glück keine.
Im September 1943 beschlossen die Nazis, die Juden Dänemarks in Konzentrationslager zu deportieren. Bohr erhielt einen Hinweis, dass die Nazis ihn verhaften wollten. Die Familie Bohr floh in Fischerbooten über das kurze Stück Wasser, das Dänemark von Schweden trennte. Schweden war offiziell neutral und nicht von den Nazis überfallen worden. Fast alle der 7000 dänischen Juden flohen 1943 über das Meer nach Schweden.
Im Oktober 1943, im Abstand von einer Woche, flogen Niels und sein Sohn Aage von Schweden über das von den Nazis besetzte Norwegen nach Großbritannien. Sie flogen in den Bombenschächten der britischen Kriegsflugzeuge, die nach Schweden kamen, um sie abzuholen. Margrethe Bohr blieb bis Kriegsende in Schweden.

Im Alter von 58 Jahren wurde Niels Bohr in einem de Havilland Mosquito von Schweden hoch über das von den Nazis besetzte Norwegen und die Nordsee nach Schottland geflogen. Während des Fluges lag er an der Stelle, an der normalerweise die Bomben des Flugzeugs platziert werden. Während des Fluges fiel seine Sauerstoffversorgung aus und er verlor das Bewusstsein. Nachdem der Pilot die Kommunikation mit Bohr verloren hatte, ahnte er, was passiert war, und brachte das Flugzeug auf eine niedrigere Höhe herunter. Bei der Landung erlangte Bohr das Bewusstsein wieder.
Nachdem sie sicher in Großbritannien angekommen waren, begannen Vater und Sohn mit wissenschaftlichen Forschungen für die britische Regierung und arbeiteten im Atombombenprojekt unter der Leitung von James Chadwick.
Im Jahr 1944 wurden Vater und Sohn in das Manhattan-Projekt involviert und verbrachten viel Zeit in den Vereinigten Staaten und in London. Um ihre Anwesenheit in Amerika geheim zu halten, reisten sie unter den Namen „Nicholas Baker“ und „James Baker“.
Einige persönliche Details und das Ende
Im Jahr 1912 heiratete Bohr Margrethe Nørlund in Kopenhagen. Sie hatten sechs Söhne, von denen einer, Aage Bohr, seinem Vater nacheifern sollte, indem er den Nobelpreis für Physik gewann.
Niels Bohr starb im Alter von 77 Jahren an plötzlichem Herzversagen in seinem Haus in Kopenhagen am 18. November 1962. Seine Asche wurde auf dem Kopenhagener Assistens-Friedhof neben den Gräbern seiner Eltern und seines Bruders Harald beigesetzt. Die Asche von Margrethe wurde ebenfalls dort beigesetzt, als sie starb.
Autor dieser Seite: The Doc
Die Bilder wurden von dieser Website digital erweitert und koloriert. © Alle Rechte vorbehalten.
Diese Seite zitieren
Bitte verwenden Sie das folgende MLA-konforme Zitat:
"Niels Bohr." Famous Scientists. famousscientists.org. 19 Dec. 2015. Web. <www.famousscientists.org/niels-bohr/>.
Veröffentlicht von FamousScientists.org
Weiteres Lesen
A. P. French, P. J. Kennedy
Niels Bohr: A Centenary Volume
Harvard University Press, 1987
Abraham Pais
Niels Bohrs Zeiten: In Physics, Philosophy, and Polity
Clarendon Press, 1993
Ray Spangenburg, Diane Kit Moser
Niels Bohr, Revised Edition
Infobase Publishing, 1 Jan 2009
Richard Rhodes
The Making of the Atomic Bomb
Simon and Schuster, 2012
J.R. Nielsen
Niels Bohr Collected Works: Volume 1 Early Work (1905 – 1911)
Elsevier, 2013