Einleitung
Die Perikardiozentese ist das nützlichste therapeutische Verfahren für die frühe Behandlung oder Diagnose von großen, symptomatischen Perikardergüssen und Herztamponaden. Die erste Beschreibung der kardialen Dekompression stammt aus dem Jahr 1653, als Riolanus eine sternale Trepanation zur Entlastung des Perikards vorschlug. Im Jahr 1911 beschrieb Marfan erstmals den subxiphoiden Zugang, der trotz der signifikanten Morbiditäts- und Mortalitätsraten (50 % bzw. 6 %) jahrzehntelang für die blinde Perikardiozentese verwendet wurde. In den folgenden Jahren haben sich die für eine sichere und erfolgreiche Perikardiozentese empfohlenen Techniken erheblich verändert, insbesondere mit der Einführung der fluoroskopischen, elektrokardiographischen und schließlich echokardiographischen Führung und mit der Beschreibung anderer Zugänge als dem substernalen (apikal und parasternal).
Kardiale Tamponade
Die kardiale Tamponade ist eine lebensbedrohliche langsame oder schnelle Kompression des Herzens durch zunehmende Perikardflüssigkeit. Das Perikard kann sich dehnen, um die Flüssigkeitsansammlung aufzunehmen, aber wenn die perikardiale Compliance nicht weiter zunehmen kann, kommt es zu einem Ausgleich der intraperikardialen Drücke (zentralvenöse, rechte und linke Herzkammer), typischerweise um 15-20 mmHg. An diesem Punkt kollabiert der rechte Ventrikel und die Hypotonie wird schwer. Der hämodynamische Effekt eines signifikanten Perikardergusses ist ein Kontinuum, da eine geringe Zunahme des Perikardinhalts das Perikard an das Herz koppelt und die atriale und insbesondere ventrikuläre Interaktion signifikant erhöht. Solche Phänomene übertreiben die normalen reziproken Atmungseffekte auf die rechte und linke Seite des Herzens. In den ersten Stadien der hämodynamischen Beeinträchtigung des Perikardergusses können die Patienten nur echokardiographische Befunde der Herzkammerkompression (Kollaps des rechten und linken Vorhofs, Kollaps des rechten Ventrikels, schwingendes Herz, Bewegung des Interventrikelseptums nach links, Stauung der Vena cava inferior) ohne klinische Anzeichen und Symptome zeigen (subklinische Tamponade). In diesen Fällen können die echokardiographischen Befunde zu empfindlich sein und eine Herztamponade bei Patienten mit nur subtilen Anzeichen eines hämodynamischen Kompromisses überdiagnostizieren. Daher ist die echokardiographische Tamponade keine eindeutige Indikation zur Perikardiozentese.
Klinisch ist die Herztamponade definiert als die dekompensierte Phase der Herzkompression, die durch erhöhten intraperikardialen Druck entsteht. Zu den klinischen Symptomen und Anzeichen gehören Dyspnoe, erhöhter Jugularvenendruck, Hypotonie, Tachykardie und Pulsus paradoxus. Mindestens eines dieser Symptome ist in über 75 % der Fälle vorhanden.
Wirkung der Perikardiozentese
Die Wirkung der Perikardiozentese ist oft unmittelbar: die Drainage von wenigen Millilitern des Ergusses erhöht das Schlagvolumen signifikant, reduziert den intraperikardialen und atrialen Druck und ermöglicht die Trennung zwischen rechtem und linkem Füllungsdruck. Tachykardie und Dyspnoe nehmen ab, während der arterielle Druck ansteigt und der Pulsus paradoxus verschwindet.
Indikationen der Perikardiozentese
Bei hämodynamisch instabilen Patienten ist ein notfallmäßiger Eingriff zwingend erforderlich, da nur die Entfernung der Flüssigkeit eine normale Ventrikelfüllung ermöglicht und ein adäquates Herzzeitvolumen wiederherstellt. Andernfalls könnte der Eingriff innerhalb von Stunden nach der Einlieferung durchgeführt und die am besten geeignete visuelle Führung und Vorgehensweise geplant werden. Vor kurzem wurde ein Scoring-Index vorgeschlagen, um bei Patienten mit Verdacht auf Tamponade zu entscheiden, ob eine dringende Perikardiozentese oder eine Drainage in den folgenden Stunden durchgeführt werden soll. Er besteht aus drei Komponenten, die bei der Erstvorstellung erhoben werden: Ätiologie, klinische Präsentation und echokardiographische Befunde.
Bei einem Perikarderguss ohne hämodynamischen Kompromiss ist eine Perikardiozentese bei einem symptomatischen mittelgroßen bis großen Erguss, der nicht auf eine medikamentöse Therapie anspricht, oder bei einem kleineren Erguss indiziert, bei Verdacht auf tuberkulöse, bakterielle oder neoplastische Perikarditis oder bei chronischem (länger als drei Monate andauerndem), großem Perikarderguss (>20 mm in der Echokardiographie in der Diastole).
Die Perikardiozentese zu diagnostischen Zwecken ist in Fällen von leichten oder mittelschweren Ergüssen (<20 mm) aus folgenden Gründen nicht gerechtfertigt: 1) geringe diagnostische Aussagekraft (die zugrundeliegende Pathologie ist oft bereits bekannt oder durch verschiedene nicht-invasive Tests identifizierbar); 2) die virale (idiopathische) Perikarditis ist in der Regel selbstlimitierend und erfordert lediglich eine entzündungshemmende Behandlung; und 3) hohes prozedurales Risiko im Vergleich zum geringen diagnostischen Ertrag.
Kontraindikationen
Es gibt keine absoluten Kontraindikationen für eine Perikardiozentese bei kardialer Tamponade und Schock. Aortendissektion und Postinfarktruptur der freien Wand sind Kontraindikationen für eine Nadelperikardiozentese (chirurgische Tamponade) aufgrund des potenziellen Risikos einer Verschlimmerung der Dissektion oder Myokardruptur durch eine schnelle Perikarddekompression und Wiederherstellung des systemischen arteriellen Drucks. Wenn jedoch ein chirurgisches Management nicht sofort verfügbar ist oder der Patient zu instabil ist, kann eine Perikardpunktion und Drainage sehr kleiner Mengen des Hämoperikards versucht werden, um den Blutdruck als Überbrückung bis zur Notoperation bei etwa 90 mmHg zu halten. Relative Kontraindikationen sind unkorrigierte Koagulopathie, Antikoagulanzien-Therapie, Thrombozytopenie (PLTc <50.000/mm3).
Zugänge
Durchleuchtungsgeführte Technik
Der durchleuchtungsgeführte Zugang war der erste, der für die perkutane Perikardiozentese verwendet wurde. Sie wird über den subxiphoiden Zugang mit einer kontrastmittelhaltigen Nadel durchgeführt, die in einem Winkel von 30° zur Haut auf die linke Schulter gerichtet ist. Die Position der Nadel im Perikardraum wird durch die Kontrastmittelinjektion bestätigt: das Auftreten einer trägen Schichtung des Kontrastmittels in der unteren Position zeigt die korrekte Position an und dass ein weicher J-Tip-Führungsdraht eingeführt werden kann. Es ist wichtig, die Position des Führungsdrahtes in mindestens zwei angiographischen Projektionen (laterale Ansicht und anterior-posteriore Ansicht) zu überprüfen.
Dieses Verfahren ist standardisiert und effektiv, kann aber nur im Herzkatheterlabor durchgeführt werden und bedeutet eine Strahlenbelastung für den Patienten und den Arzt. Dieses Verfahren könnte jedoch sehr nützlich sein, um eine iatrogene Tamponade während perkutaner Eingriffe zu behandeln. Eine echokardiographische Untersuchung zur Beurteilung der Verteilung und des Ausmaßes des Perikardergusses sollte, wann immer möglich, dem durchleuchtungsgeführten Verfahren vorausgehen.
Computertomographie-geführte Technik
In den letzten Jahren wurde über die Durchführbarkeit der Perikardiozentese unter computertomographischer (CT) Führung berichtet. Durch den planenden CT-Scan wird die volle Ausdehnung des Perikardergusses beurteilt und der optimale Eintrittspunkt definiert und auf der Haut markiert. Anschließend wird die Nadel in den Perikarderguss vorgeschoben und ein einzelner CT-Scan zur Verifizierung der Nadelposition verwendet. Diese Technik erlaubt keine kontinuierliche Visualisierung der Nadel und ist mit einer erheblichen Strahlenbelastung für den Patienten verbunden. Außerdem ist sie nicht überall verfügbar, logistisch nicht durchführbar und zeitaufwendig (mediane Dauer von 65 Minuten). Sie kann jedoch bei Patienten mit schlechtem Ultraschallfenster erfolgreich eingesetzt werden und kann einen lokalisierten Erguss sehr gut darstellen, wodurch die beste Eintrittsstelle identifiziert werden kann. Darüber hinaus kann ein CT-Scan die Dichte des Perikardergusses messen und so ein Scheitern des Eingriffs bei hochviskösen Ergüssen, wie z. B. eitrigen Ergüssen und intraperikardialen Hämatomen, vermeiden. Schließlich ermöglicht ein CT-Scan die Beurteilung des gesamten Brustkorbs und die Erkennung von assoziierten Anomalien, was bei der Identifizierung der zugrunde liegenden Erkrankung hilfreich ist.
Echo-geführte Technik
Die echokardiographie-geführte Perikardiozentese ist eine sichere und einfache Technik, die 1979 an der Mayo Clinic eingeführt wurde und heute weit verbreitet ist. Der echokardiographie-geführte Ansatz erlaubt es, die Position des Ergusses, die ideale Eintrittsstelle und die Nadeltrajektorie für die Perikardiozentese zu definieren. Es gibt zwei verschiedene Ansätze für die Echoführung: Der erste (von der Mayo Clinic beschrieben) ist die echogestützte Methode, bei der sich der Bediener die optimale Nadeltrajektorie merkt und die Nadel ohne kontinuierliche Ultraschallvisualisierung in Richtung Perikardraum vorschiebt. Der zweite Ansatz ist die echogestützte Methode mit einer kontinuierlichen echokardiographischen Überwachung. Es wurde auch vorgeschlagen, einen auf dem Ultraschallwandler montierten Nadelträger zu verwenden, um die Nadel in den Perikardraum vorzuschieben.
Punktionsstelle
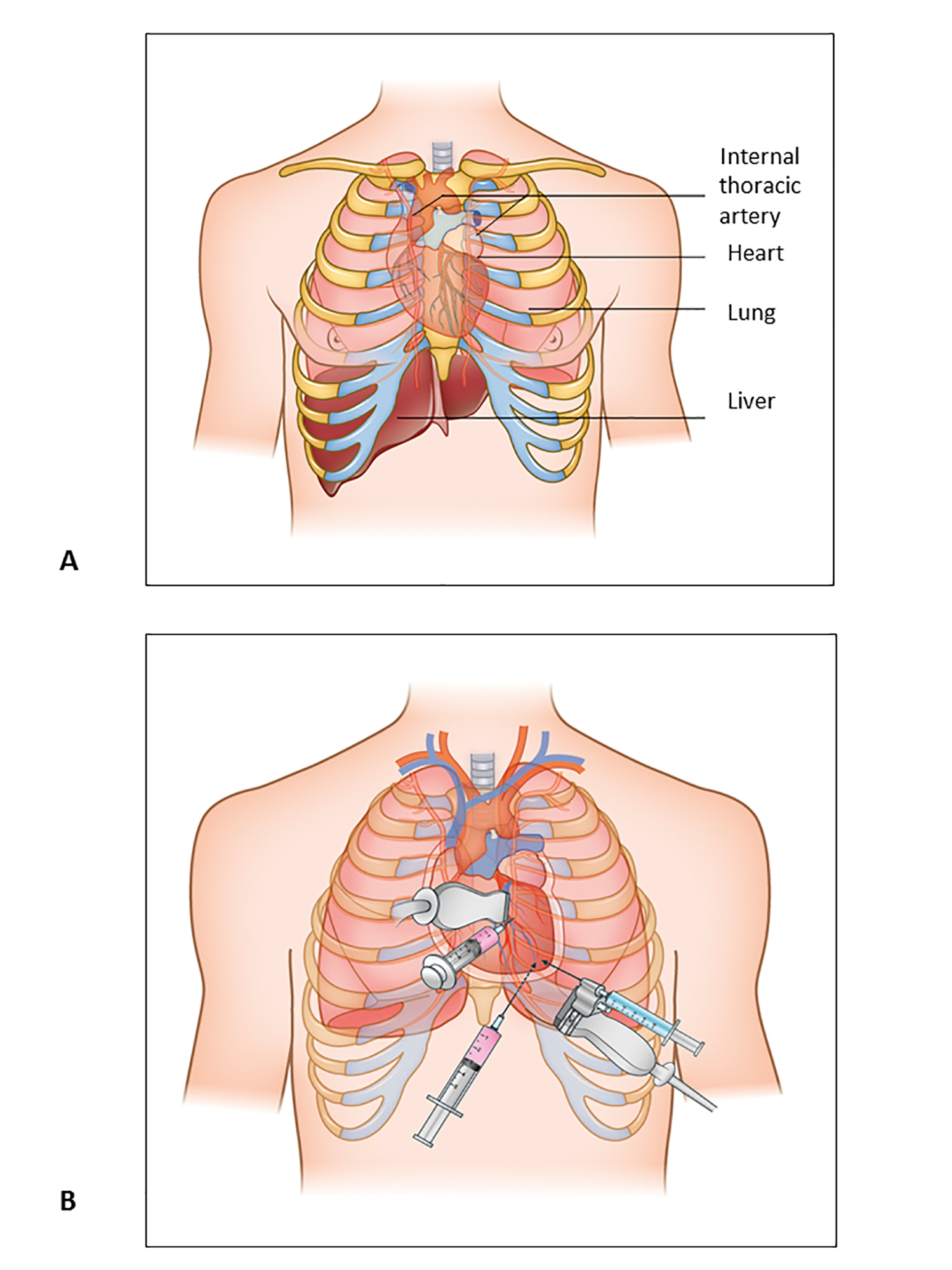
Drei Hauptzugänge können für die Perikardpunktion verwendet werden: der apikale, der subcostale oder der parasternale Zugang.
Traditionell wurde ein subcostaler Zugang bevorzugt, vor allem weil er als der sicherste Weg ohne Bildführung angesehen wurde. Allerdings ist der Perikarderguss nicht immer zirkumferenziell und gleichmäßig verteilt; daher ist eine Ultraschallbeurteilung der idealen Eintrittsstelle für die Drainage von grundlegender Bedeutung für den Erfolg des Verfahrens. Die Mayo Clinic befürwortet die Auswahl des Zugangs auf der Grundlage rein echokardiographischer Befunde und definiert die optimale Eintrittsstelle als den Punkt, an dem der Perikardraum der Sonde am nächsten liegt und die Flüssigkeitsansammlung maximal ist, ohne dazwischen liegende lebenswichtige Organe. Diese Stelle ist häufiger para-apikal als subcostal. Darüber hinaus zeigte eine Beobachtungsserie zur echogesteuerten Perikardiozentese eine höhere Erfolgsrate und eine geringere Komplikationsrate, wenn die Eintrittsstelle echokardiographisch ausgewählt wurde, als wenn routinemäßig der subxiphoide Zugang verwendet wurde (Tabelle 1, Abbildung 1).
Tabelle 1. Merkmale der verschiedenen Perikardiozentese-Ansätze
|
Punktionsort |
Beschreibung |
Nachteile |
Nachteile |
|---|---|---|---|
|
Apikal |
Die Einstichstelle der Nadel liegt 1-2 cm lateral zum Apexschlag innerhalb des fünften, sechsten oder siebten Interkostalraumes. Führen Sie die Nadel über den oberen Rand der Rippe, um Interkostalnerven und -gefäße zu vermeiden. |
Risiko einer Ventrikelpunktion aufgrund der Nähe zum linken Ventrikel. Erhöhtes Risiko für Pneumothorax wegen der Nähe zum linken Pleuraraum. |
Die dickere linke Ventrikelwand dichtet sich nach der Punktion eher selbst ab. Da der Ultraschall keine Luft durchdringt, wird bei der echokardiographischen Führung die Lunge vermieden. Der Weg zum Perikard ist kürzer. |
|
Parasternal |
Die Einstichstelle der Nadel befindet sich im fünften linken Interkostalraum in der Nähe des Sternumrandes. Führen Sie die Nadel senkrecht zur Haut vor (auf Höhe der Herzkerbe der linken Lunge). |
Risiko eines Pneumothorax und einer Punktion der inneren Thoraxgefäße (wenn die Nadel mehr als 1 cm seitlich eingeführt wird). |
Echokardiographische Führung, auch mit Phasenarraysonde, bietet eine gute Visualisierung der perikardialen Strukturen. |
|
Subxiphoid |
Die Einstichstelle der Nadel befindet sich zwischen dem Xiphisternum und dem linken Rippenbogen. Sobald Sie unter dem Knorpelkäfig sind, senken Sie die Nadel in einem Winkel von 15 bis 30 Grad ab, wobei die Bauchdecke in Richtung der linken Schulter zeigt. |
Ein steilerer Winkel kann in die Peritonealhöhle eindringen, und eine mediale Richtung erhöht das Risiko einer Punktion des rechten Vorhofs. In einigen Fällen kann der linke Leberlappen absichtlich durchquert werden, wenn keine alternative Stelle verfügbar ist. Der Weg zur Flüssigkeit ist länger. |
Geringere Gefahr eines Pneumothorax. |
Abbildung 1. Perikardiozentese: Anatomische Strukturen und Zugänge.
A) Anatomische Strukturen, die bei der Perikardiozentese zu beachten sind.
B) Drei Hauptzugänge für die Perikardiozentese, parasternal, substernal und apikal.
Technische Aspekte des echogestützten Verfahrens
Eine Ausrüstungsliste finden Sie in Tabelle 2.
Tabelle 2. Erforderliche Ausrüstung für die Durchführung der echogesteuerten Perikardiozentese mit oder ohne sondengetragenem Nadelsystem.
Ausrüstung für die echogestützte Perikardiozentese
Echokardiographie mit einer Herzsonde
Sterile Sondenhülle und steriles Echogel
16-18 Gauge, Teflonummantelte Nadel
6 Fr bis 8 Fr Dilatator und Einführschleuse
J-Spitzen-Führungsdraht
Drainagekatheter: Pigtail-Angiokatheter 6 Fr bis 8 Fr oder spezielles Perikarddrainage-Set
Einweg-Spülsystem zur Aufrechterhaltung der Durchgängigkeit des Katheters
Ausrüstung für Echtzeit-Time Echo-Monitored Procedure
Mehrwinkelhalterung zur Montage an der Echosonde
Nadelführungsset steril
18 Gauge, 9 cm Nadel (oder 15 cm für subxiphoiden Zugang)
6 Fr bis 8 Fr Dilatator
Für die sichere Durchführung der Perikardiozentese ist eine vorherige Vorbereitung unerlässlich. Die Thrombozytenzahl und das Gerinnungsprofil sollten überprüft werden. Gepackte Erythrozyteneinheiten sollten vor der Durchführung von Nicht-Notfallmaßnahmen bereitstehen. Die elektrokardiographische Überwachung des Patienten ist in einer geeigneten Umgebung mit Reanimationsausrüstung erforderlich. Ein zentraler Venenkatheter ist unerlässlich, um den Druck im rechten Vorhof zu überwachen und eine schnelle Infusion von Flüssigkeiten und Medikamenten zu ermöglichen, falls dies angezeigt ist. Eine kontinuierliche arterielle Drucküberwachung ist indiziert, um das Vorhandensein eines Pulsus paradoxus zu erkennen und um eine plötzliche hämodynamische Instabilität zu erkennen und schnell zu korrigieren.
Eine vorläufige echokardiographische Beurteilung mit verschiedenen Ansichten wird empfohlen, um die Größe und Verteilung des Ergusses zu beurteilen, die richtige Eintrittsstelle auszuwählen und auch um den Eingriff zu überwachen. Der Patient sollte in halbliegender Position in einem Winkel von etwa 30° gelagert und leicht nach links gedreht werden, um die Flüssigkeitsansammlung im inferior-anterioren Teil des Brustkorbs zu verstärken. Nach entsprechender Desinfektion des Operationsfeldes wird ein Lokalanästhetikum an der Punktionsstelle verabreicht. Die Trajektorie der Nadel wird durch den Winkel zwischen der Sonde und der Brustwand definiert. Der Bediener sollte sich die optimale Nadeltrajektorie vor Augen führen und dann eine teflonummantelte 16-18-Gauge-Nadel mit einer aufgesetzten, mit Kochsalzlösung gefüllten Spritze in Richtung des flüssigkeitsgefüllten Raums vorschieben. Wenn Flüssigkeit aspiriert wird, sollte die Nadel etwa 2 mm weiter vorgeschoben werden. Die Hülse sollte über die Nadel vorgeschoben und der Stahlkern zurückgezogen werden, wobei nur die Hülse im Perikardraum verbleibt. Ein Führungsdraht sollte durch die Hülse vorgeschoben werden, die dann entfernt werden kann. Ein blutiges Aspirat kann auf eine Myokardpunktion oder einen hämorrhagischen Perikarderguss hinweisen. Die extrakardiale Lage der Spitze kann durch Injektion von 5 ml bewegter Kochsalzlösung als Infusion bestätigt werden: Die Blasen können durch Echokardiographie im Perikardraum sichtbar gemacht werden. Es sollte eine kleine Inzision an der Eintrittsstelle vorgenommen werden, gefolgt von der Einführung eines ummantelten Dilatators (6 Fr bis 8 Fr) über die Führung. Der Dilatator sollte entfernt und ein Pigtail-Katheter direkt in die Ummantelung eingeführt werden. Der Perikarderguss wird mittels Spritzenabsaugung abgesaugt und der Katheter nach Spülung mit 5 ml heparinisierter Kochsalzlösung verschlossen.
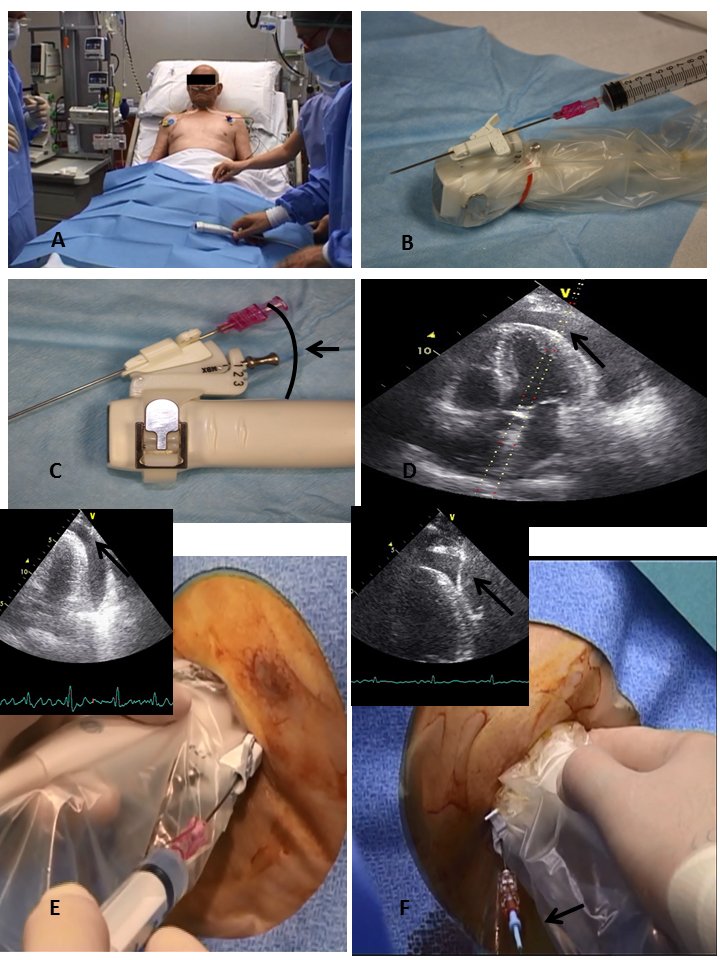
Eine andere Vorgehensweise nutzt einen auf dem Schallkopf montierten Nadelträger, um die Nadel unter ständiger Visualisierung vorzuschieben (Echtzeit, echo-überwachtes Verfahren). In den meisten Fällen wird das Verfahren von zwei Ärzten durchgeführt – einer, der das Echokardiogramm durchführt und ein anderer, der die Punktion und Drainage vornimmt – Abbildung 2.
Abbildung 2. Echo-Guided Pericardiocentesis-Verfahren.
Lagern Sie den Patienten in eine halb liegende Position (Feld A), verwenden Sie eine sondenmontierte Nadel, die mit einer sterilen Hülle bedeckt ist (Feld B), wählen Sie den richtigen Winkel für die Nadel (Felder C und D), schieben Sie die Nadel langsam in Aspiration durch das Gewebe, bis eine kontinuierliche Visualisierung der Spitze (schwarzer Pfeil) vorliegt (Feld E), führen Sie einen Draht mit J-Spitze unter kontinuierlicher Visualisierung in die Nadel ein (schwarzer Pfeil) (Feld F).
Die Vorbereitung des Patienten ist die gleiche wie oben beschrieben. Die Halterung sollte an der Sonde montiert werden, um das Nadelführungsset zu unterstützen. Die Halterung unterstützt die Nadel mit verschiedenen Winkeln und der Bediener kann zwischen einem engeren oder weiteren Winkel wählen. Die Sonde muss mit einer sterilen Hülle bedeckt werden und das Nadelführungsset muss auf der ummantelten Sonde montiert werden.
Wenn die Platzierung und Richtung der Nadel gewählt sind, wird eine 16-18 Gauge, 9 cm lange Nadel an eine Spritze angeschlossen und langsam in Aspiration durch das Gewebe vorgeschoben, bis eine kontinuierliche Visualisierung der Spitze erfolgt. Wenn der Perikarderguss erreicht und die Platzierung echokardiographisch bestätigt ist, wird ein J-Spitzen-Draht unter kontinuierlicher Visualisierung in den Perikardraum eingeführt und ein Pigtail-Katheter sollte nach der Seldinger-Technik eingeführt werden.
Post-Prozedur-Management
Die Aspiration wird alle vier bis sechs Stunden wiederholt, und der Katheter kann entfernt werden, wenn die Drainage auf weniger als 25 bis 30 ml in 24 Stunden zurückgegangen ist. Die Pflege des Perikardkatheters ist die gleiche wie die des zentralen Venenkatheters. Nach dem Eingriff werden alle Patienten einer Röntgenuntersuchung des Brustkorbs unterzogen, um das Vorhandensein eines Pneumothorax auszuschließen.
Medizinisches Management
Medizinisches Management ist nur eine vorübergehende Maßnahme für Tamponadepatienten, während sie auf die Perikardiozentese warten.
Hypotensive Patienten (systolischer arterieller Druck <100 mmHg) mit Hypovolämie können mit einem geringen Volumen (250-500 ml) normaler Kochsalzlösung behandelt werden, da dies nachweislich die hämodynamischen Parameter verbessert. Die Infusion höherer Volumina kann jedoch den Keildruck und den intraperikardialen Druck erhöhen und das Herzzeitvolumen reduzieren. Die intravenöse Verabreichung von Diuretika ist kontraindiziert und könnte bei Patienten am Rande des Kompensationsmechanismus bei Tamponade tödlich sein. Sowohl Dopamin als auch Dobutamin verbessern die Hämodynamik: Dobutamin hat eine größere Beta-Aktivität und ist daher möglicherweise vorzuziehen. Die Nützlichkeit von Inotropika ist jedoch im Allgemeinen begrenzt, da die endogene adrenerge Stimulation unter Tamponadebedingungen bereits erhöht ist. Eine Antibiotikaprophylaxe ist nicht indiziert, es sei denn, der Eingriff wurde in einer Notfallsituation ohne ausreichende Asepsis durchgeführt.
Komplikationen
Die Rate an schweren Komplikationen, die in großen Beobachtungsstudien für die echogestützte oder fluoroskopische Perikardiozentese berichtet wurden, liegt bei 0,3-3,9 %, die Rate an leichten Komplikationen bei 0,4-20 %.
Zu den schwerwiegendsten Komplikationen gehören der Tod, die Verletzung der Herzkammern, die Verletzung der Koronararterien oder der Interkostalgefäße, die Punktion der abdominalen Viszera oder der Peritonealhöhle, der Pneumothorax, der eine Thoraxdrainage erfordert, das Pneumoperikard, ventrikuläre Arrhythmien und das perikardiale Dekompressionssyndrom. Die Myokard- und Koronarpunktion kann zunächst stumm verlaufen und sich mit einem verzögerten Hämoperikard oder einem intraperikardialen Thrombus präsentieren.
Das perikardiale Dekompressionssyndrom ist ein seltenes, potenziell lebensbedrohliches Syndrom mit einem breiten klinischen Spektrum (vom Lungenödem bis zum kardiogenen Schock). Es entwickelt sich im Allgemeinen nach einer erfolgreichen Perikarddrainage, einige Stunden bis Tage später. Der Mechanismus dieser Situation ist noch nicht gut verstanden. Die einfachste Erklärung ist jedoch eine akute linksventrikuläre Überlastung durch eine erhöhte rechtsseitige Vorlast in Verbindung mit einer persistierenden katecholaminergen peripheren Vasokonstriktion. Bis heute gibt es keine wirksamen Empfehlungen zur Vorbeugung dieses Syndroms, außer genügend Flüssigkeit zu entfernen, um den zentralvenösen und systemischen Blutdruck zu normalisieren (nicht >1 L) und die Entfernung in den folgenden Stunden abzuschließen.
Mindere Komplikationen sind vorübergehende vasovagale Hypotonie und Bradykardie, supraventrikuläre Arrhythmien, Pneumothorax ohne hämodynamische Instabilität und pleuroperikardiale Fisteln.
Einige Autoren haben vorgeschlagen, dass dem periprozeduralen Management der Antikoagulanzienbehandlung besondere Aufmerksamkeit geschenkt werden muss und schlagen vor, dass bei Vorliegen schwerer Gerinnungsstörungen die Perikardiozentese verschoben werden sollte, bis eine ausreichende Bluttransfusion oder eine andere geeignete hämatologische Behandlung erfolgt ist, wenn keine offene Tamponade vorliegt. Im Rahmen eines iatrogenen Perikardergusses gilt eine vollständige Antikoagulation als Hauptrisikofaktor sowohl für eine Tamponade als auch für deren Folgeerscheinungen.
Perlen und Fallstricke
Respiratorisches Management
Spontane versus mechanische Beatmung und PaCO2-Werte beeinflussen signifikant die Entwicklung einer Perikardtamponade. Der Perikarddruck sinkt um 3-6 mmHg, wenn der PaCO2 auf 24 mmHg sinkt; umgekehrt steigt der Perikarddruck um 2-4 mmHg, wenn der PaCO2 57 mmHg erreicht. Erhöhte intrathorakale Drücke während der Inspirationsphase der mechanischen Beatmung können das Herzzeitvolumen bei Patienten mit Tamponade um bis zu 25 % verringern. Patienten mit Verdacht auf Herztamponade sollten daher nicht mit Überdruck beatmet werden, es sei denn, es ist unbedingt notwendig, um eine weitere hämodynamische Beeinträchtigung zu vermeiden.
Katheterdrainageversorgung
Der Verschluss des Katheters kann in bis zu 10% der Fälle auftreten. Um die Katheterdurchgängigkeit zu optimieren, kann es sinnvoll sein, alle sechs Stunden eine intermittierende Aspiration durchzuführen und zwischen den Aspirationen ein kontinuierliches Einwegspülsystem zu verwenden. Dies ermöglicht eine lange Durchgängigkeit des Katheters und eine begrenzte Manipulation bei der Entnahme des Ergusses, wodurch die Gefahr einer Kontamination der Perikardflüssigkeit verringert wird.
Vorbeugung der Herztamponade
Eine Perikarddrainage für 24 bis 72 Stunden ist ausreichend, um ein Wiederauftreten der Perikardtamponade in der Mehrzahl der Fälle zu vermeiden. Die Rezidivrate nach dem ersten Eingriff beträgt 27-55% bei Patienten, die sich einer einfachen Perikardiozentese unterziehen, und 12-24% bei denen, die eine erweiterte Drainage erhalten. Das Unterlassen einer erweiterten Katheterdrainage ist ein wichtiger unabhängiger Prädiktor für ein Rezidiv. Es ist wichtig, den Perikardsack so vollständig wie möglich zu entleeren und den Katheter bis zu 72 Stunden oder länger zu belassen, wenn die Flüssigkeitsansammlung mehr als 30 ml in 24 Stunden beträgt. Komplikationen im Zusammenhang mit der Verwendung eines Perikardkatheters sind selten. In 781 Fällen, in denen diese Methode angewendet wurde, wurde nur ein Fall von Bakteriämie berichtet. Eine erneute Ansammlung von Perikardflüssigkeit ist bei Patienten mit malignen Perikardergüssen häufig. Bei diesen Patienten wurden mehrere Verfahren vorgeschlagen, um ein Wiederauftreten der Tamponade zu verhindern. Zu diesen Ansätzen gehören die wiederholte Perikardpunktion, die bei Patienten im Endstadium der Erkrankung, bei intraperikardialer Sklerose, systemischer Chemotherapie, Strahlentherapie, chirurgischem Eingriff oder perkutaner Ballonperikardiotomie wahrscheinlich das Verfahren der Wahl ist.
Falsch negative und falsch positive echokardiographische Befunde
Der häufigste falsch positive echokardiographische Nachweis einer Tamponade ist der rechtsatriale Kollaps. Dieses Zeichen, wie auch der rechtsventrikuläre diastolische Kollaps, kann bei volumenverarmten Patienten hervorgehoben werden. In dieser Situation ist der intraperikardiale Druck mindestens so hoch wie der rechtsatriale und rechtsventrikuläre Druck, die aufgrund der niedrigen Vorlast vermindert sind. Darüber hinaus kann ein großer Pleuraerguss einen erhöhten intraperikardialen Druck verursachen, der ausreicht, um echokardiographische Befunde einer Herztamponade zu verursachen. In dieser Situation ist der angemessene therapeutische Ansatz die Drainage des Pleuraergusses. Andererseits wird bei Patienten mit hohen rechtsseitigen Drücken, die auf pulmonale Hypertonie, Lungenembolie oder rechtsventrikuläre Volumenüberlastung zurückzuführen sind, bei der Herztamponade kein rechtsatrialer oder rechtsventrikulärer Kollaps festgestellt. Der Grund für dieses Phänomen ist ein erhöhter intraperikardialer Druck, der den rechtsventrikulären oder rechtsatrialen Druck nicht ausgleicht.
Hämorrhagischer Erguss
Falsch-negative Ergebnisse der Perikardpunktion werden in 20-40% der Fälle eines hämorrhagischen Ergusses erzielt, selbst wenn die Perikardpunktion ohne Verzögerung durchgeführt werden kann. Falsch negative Ergebnisse können durch die schnelle Bildung von Gerinnseln verursacht werden, die die Aspiration von Blut behindern. Daher sollte die Nicht-Aspiration von Blut bei traumatischen Thoraxverletzungen die mögliche Diagnose eines hämorrhagischen Ergusses nicht ausschließen und die Evakuierung verzögern. In diesen Fällen ermöglicht die Visualisierung der Nadel im Perikardraum die Bestätigung des Erreichens des Raumes und vermeidet wiederholte Punktionen.
Auswirkungen auf die Prognose
Die Perikardiozentese ist ein lebensrettendes Manöver, wenn eine Herztamponade mit schwerer hämodynamischer Beeinträchtigung auftritt und muss mit Dringlichkeit durchgeführt werden. Es gibt keine randomisierten Studien in diesem Setting. Wenn eine Perikardiozentese durchgeführt wurde, hängt die Prognose von der Grunderkrankung ab, sie ist schlecht bei neoplastischer Ätiologie und ausgezeichnet bei idiopathischer/viraler Perikarditis. Bei Patienten mit Perikarderguss ohne Tamponade, aber Verdacht auf tuberkulöse, bakterielle oder neoplastische Perikarditis, ist die Perikardiozentese obligatorisch, da eine korrekte Diagnose durch die Analyse der Perikardflüssigkeit die richtige Therapie ermöglicht und die Wahrscheinlichkeit einer Entwicklung zu einer konstriktiven Perikarditis verringert. Im Falle eines chronischen großen Perikardergusses ist die Prognose im Allgemeinen gut, aber es kann ein 35%iges Risiko für die Entwicklung einer Herztamponade bestehen.
Schlussfolgerung
Die Perikardiozentese kann ein potenziell lebensrettender Eingriff sein, der ein hohes Risiko für Komplikationen birgt. Dabei sind die Unterstützung durch bildgebende Verfahren und die sorgfältige Planung der richtigen Eintrittsstelle grundlegend für einen sicheren und erfolgreichen Eingriff.