Das Zeichnen einer Uhr ist ein einfacher und effektiver Test, der in die neuropsychiatrische Beurteilung von Patienten einbezogen werden kann.4 Reviews der Forschungsliteratur unterstützen seine Verwendung als zuverlässiges Screening-Instrument für kognitive Dysfunktion, insbesondere für Demenz.5,6 Obwohl er bereits seit den 1960er Jahren verwendet wird, wurde er 1983 populär, als Goodglass und Kaplan ihn in die Boston Aphasia Battery aufnahmen.7-9 Obwohl die meisten Studien den Uhrenzieh-Test zur Beurteilung der Kognition im Rahmen des Screenings auf Demenz verwenden, wurden auch andere Bedingungen untersucht. So wurde in neueren Studien über die Verwendung eines Uhr-Zeichen-Tests zur Diagnose und Einstufung des Schweregrads einer hepatischen Enzephalopathie, zur Vorhersage von Rehabilitationsergebnissen nach einer traumatischen Hirnverletzung (TBI) und zur Beurteilung des Funktionsstatus bei Veteranen mit einsatzbedingter leichter TBI berichtet.10-12 Im Laufe der Jahre wurden mindestens 13 Scoring-Systeme eingeführt. Shulman kam in seiner Übersichtsarbeit zu dem Schluss, dass Uhrenzieh-Tests den Mini-Mental State Exam (MMSE) ergänzen und einen bedeutenden Fortschritt bei der Früherkennung von Demenz und der Überwachung kognitiver Veränderungen darstellen, und wies darauf hin, dass ein einfaches Scoring-System mit Schwerpunkt auf den qualitativen Aspekten des Uhrenziehens seinen Nutzen maximieren sollte.5 Die Dokumentation der Art der Uhrenzieh-Fehler kann zur klinischen Bewertung von Patienten mit vermuteten neuropsychiatrischen Störungen und Syndromen beitragen, sowohl bei der Erst- als auch bei der Folgeuntersuchung. Es hat auch einen großen pädagogischen Wert für die Familien der Patienten und für die Ausbildung, da es eine leicht verständliche Demonstration von subtilen kognitiven Defiziten bietet, die manchmal bei einer Routineuntersuchung am Krankenbett schwer zu erkennen sind. Der Schwerpunkt dieser Übersichtsarbeit liegt auf der Darstellung der wichtigsten qualitativen Uhrzeichenfehler und der Evidenz, die die Leistung mit der Neuroanatomie verbindet. Die große Variabilität in der Art und Weise, wie Uhr-Zeichen-Tests durchgeführt und ausgewertet werden, geht über den Rahmen dieser Übersicht hinaus.5
Uhr-Zeichen-Fehler
Das am häufigsten verwendete System qualitativer Uhr-Zeichen-Fehler wurde von Rouleau beschrieben.1 Er kategorisierte fünf Arten von Fehlern zusätzlich zur Größe der Uhr (Abbildung 1): 1) grafische Schwierigkeiten; 2) reizgebundene Reaktion; 3) konzeptuelles Defizit; 4) räumliches und/oder planerisches Defizit; und 5) Perseveration. Es ist wichtig anzumerken, dass viele Publikationen nicht alle sechs qualitativen Fehler einbeziehen. Der Schwerpunkt liegt eher auf dem Vergleich von Fehlern aufgrund von reizgebundenen Reaktionen, konzeptionellen Defiziten, räumlichen und/oder planerischen Schwierigkeiten oder Perseveration. Wie bereits erwähnt, gibt es auch Unterschiede in der Art und Weise, wie die Uhr-Zeichentests durchgeführt werden. Einige Tests bieten einen vorgezeichneten Kreis und verschiedene Zeitvorgaben. Bei den meisten formalen Tests wird der Patient zuerst angewiesen, eine Uhr zu zeichnen (d.h. Zeichnen auf Kommando) und dann eine Uhr zu kopieren (d.h. Kopieren auf Kommando). Es gibt Hinweise darauf, dass Patienten mit Alzheimer-Krankheit (AD) weniger Fehler beim Zeichnen von Uhren machen, wenn sie aufgefordert werden, eine Uhr zu kopieren, vermutlich weil die exekutiven Funktionen und das semantische Gedächtnis weniger beansprucht werden.1

Abbildung 1. Repräsentative Darstellung von häufigen Arten von Uhrzeichnungsfehlern.1
Größe der Uhr (nicht abgebildet)
Eine Uhrzeichnung gilt als klein, wenn sie weniger als 1,5 Zoll misst, und groß, wenn sie mehr als 5 Zoll misst. Patienten mit der Huntington-Krankheit (HD) haben eine höhere Inzidenz von kleinen Uhren, während Patienten mit Alzheimer eine höhere Inzidenz von großen Uhren haben.1 Die kleinen Uhren, die bei HD gesehen werden, können auf die Mikrographie zurückzuführen sein, die bei Störungen auftritt, die die Basalganglien betreffen. Die großen Uhren, die bei Alzheimer gesehen werden, können das Ergebnis einer schlechten visuell-räumlichen Planung aufgrund einer Beeinträchtigung der exekutiven (Frontallappen) und visuell-räumlichen (rechter Parietallappen) Funktion sein.
Graphische Schwierigkeiten
Graphische Schwierigkeiten liegen vor, wenn die Linien nicht präzise sind, was entweder zu Verzerrungen des Ziffernblatts oder zu schwer lesbaren Zahlen führt. Die Zeiger sind nicht gerade und verbinden sich manchmal nicht in der Mitte. Die Gesamtdarstellung kann ungenau und unbeholfen wirken, aber die Zeichnung ist in der Regel noch als Uhr zu erkennen. Grafische Fehler treten bei HD und bei moderaten vaskulären Demenzen häufiger auf als bei AD.1,13 Es wurde festgestellt, dass sich grafische Fehler bei vaskulärer Demenz mit fortschreitender Erkrankung verschlimmern.13 Grafische Schwierigkeiten, die sowohl bei Huntington als auch bei vaskulären Demenzen auftreten, sind wahrscheinlich das Ergebnis einer sekundären Störung der frontostriatalen Schaltkreise, die für die Koordination der Feinmotorik und der Planung notwendig sind.
Stimulus-gebundene Reaktion
Eine stimulus-gebundene Reaktion ist die Tendenz des Zeichnens, von einem einzigen Stimulus dominiert oder gelenkt zu werden, meist in Verbindung mit den Zeitvorgaben. Normalerweise lauten die Anweisungen, die Zeit auf „10 nach 11“ zu stellen. Bei einem Fehler werden die Zeiger auf „10 ‚til 11“ statt auf „10 nach 11“ eingestellt. Der Patient versäumt es, die „10“ in „10 nach 11“ in eine „2“ umzucodieren, um den Minutenzeiger einzustellen. Der Patient wird von der starken Reizquelle (d.h. „10“) „angezogen“ und nicht von der angemessenen Reaktion, die einen komplexeren Vorgang beinhaltet (d.h. das Stellen des Minutenzeigers auf „2“). Bei der zweiten Art von stimulusgebundenem Fehler steht die „1“ in der Nähe der „11“ oder zwischen „10 und 11“ auf der Uhr. Die Zeiger können fehlen oder auf „10“ und/oder „11“ zeigen. Diese zweite Art von stimulusgebundenem Fehler kann auch als konzeptioneller Fehler gewertet werden. In mehreren Studien wurde berichtet, dass stimulusgebundene Fehler bei Alzheimer häufiger vorkommen als bei Huntington, Morbus Parkinson oder frontotemporaler Demenz.1,14,15 Es wurden jedoch auch gegenteilige Ergebnisse berichtet, wonach stimulusgebundene Fehler bei Morbus Parkinson mit Demenz häufiger vorkommen als bei Alzheimer.16 Eine Möglichkeit, diese Befunde in Einklang zu bringen, ist, dass die frontostriatalen Schaltkreise zu dem Zeitpunkt, an dem Morbus Parkinson zur Demenz fortschreitet, bereits stark beeinträchtigt sind, was zu Defiziten in der Exekutivfunktion führt.
Konzeptuelle Defizite
Konzeptuelle Defizite sind definiert als ein Verlust oder eine Beeinträchtigung des Zugriffs auf das Wissen über die Eigenschaften, Merkmale und Bedeutung einer Uhr. Diese Kategorie umfasst eine große Vielfalt von Fehlern. Konzeptuelle Defizite beim Zeichnen von Uhren können auf eine Zeichnung zurückzuführen sein, die nicht wie eine Uhr aussieht (d.h. falsche Darstellung der Uhr) oder auf eine Zeichnung mit Zeigern, die keine Zeit vermitteln (d.h. falsche Darstellung der Zeit). Falsche Darstellung der Uhr deutet auf die Nichtverfügbarkeit einer korrekten grafischen Darstellung einer Uhr hin. Falsche Repräsentation der Zeit (z. B. fehlende Zeiger, unzureichend dargestellte Zeiger, die Zeit auf der Uhr geschrieben) deutet auf ein Defizit in der Kenntnis des Merkmals hin, das den größten Teil der Bedeutung einer Uhr ausmacht, nämlich die Zeit zu kommunizieren.
Verschiedene Studien haben herausgefunden, dass konzeptuelle Defizite beim Zeichnen von Uhren bei Alzheimer häufiger und früher im Verlauf der Krankheitsprogression auftreten als bei Huntington, Morbus Parkinson, vaskulärer Demenz oder frontotemporaler Demenz.14,16 Defizite können bereits bei leichten Fällen auftreten und wurden häufiger beobachtet, als die AD schwerer wurde.1,17-19 Es gibt Hinweise darauf, dass konzeptionelle Fehler bei Patienten mit leichter kognitiver Beeinträchtigung (MCI) häufiger auftreten als bei normalen Probanden, aber das Zeichnen der Uhr wird nicht als alleiniges Screening-Instrument für MCI angesehen.19-21 Eine Studie zu Läsionen/Defiziten fand heraus, dass Verletzungen im linken inferioren frontal-parietalen operculären Kortex mit Zeiteinstellungsfehlern assoziiert waren.22 Konzeptuelle Defizite sind wahrscheinlich auf eine Beeinträchtigung des semantischen Gedächtnisses zurückzuführen, einer primären Funktion der lateralen Temporallappen.23 Das semantische Gedächtnis bezieht sich auf unseren Speicher von konzeptuellem und faktischem Wissen, das nicht mit einem spezifischen Gedächtnis verbunden ist (d.h., episodisches Gedächtnis).
Raum- und/oder Planungsdefizite
Raum- und Planungsdefizite beruhen auf Fehlern in der Anordnung von Zahlen auf der Uhrzeichnung (z.B. Vernachlässigung der linken Hemisphäre, Planungsdefizite, die zu Lücken in den Zahlenabständen führen, Defizite in der räumlichen Anordnung von Zahlen in Abwesenheit eines spezifischen Musters in der räumlichen Desorganisation, Zahlen, die außerhalb des Zifferblatts geschrieben werden, Zahlen, die gegen den Uhrzeigersinn geschrieben werden). Es wurde festgestellt, dass räumliche/Planungsdefizite bei AD häufiger auftreten als bei frontotemporaler Demenz oder Schizophrenie.14,24 Dies ist wahrscheinlich auf eine stärkere Beteiligung des Parietallappens bei AD zurückzuführen. Bei Morbus Parkinson mit Demenz, der diffusen Lewy-Body-Krankheit (DLB) oder vaskulärer Demenz treten mehr räumliche/planerische Defizite auf als bei AD.13,25 Diese Befunde sind wahrscheinlich auf die subkortikale Beteiligung bei diesen Erkrankungen zurückzuführen. Fehler beim Zeichnen von Uhren aufgrund von räumlichen/planerischen Defiziten sind auf eine Beeinträchtigung der nicht-dominanten rechten Hemisphäre, insbesondere des rechten Parietallappens, zurückzuführen.22 Der vielleicht am häufigsten auftretende Fehler beim Zeichnen von Uhren wird bei Patienten mit einer Läsion des rechten Parietallappens beobachtet, die zu einer Vernachlässigung der linken Hemisphäre führt (die Uhr hat möglicherweise alle Zahlen auf der rechten Seite ausgerichtet). Im Falle eines Schlaganfalls ist dies tendenziell in der akuten Phase deutlicher. Die Patienten können sogar eine Anosognosie haben und jegliche Fehler oder Probleme mit dem Ziffernblatt leugnen. Darüber hinaus werden Schaltkreise, die zwischen dem Parietallappen und dem Frontallappen (frontoparietale Schaltkreise) und zwischen dem Frontallappen und subkortikalen Bereichen (frontostriatale Schaltkreise) kommunizieren, benötigt, um ein Zifferblatt zu planen und genau zu zeichnen. Frontoparietale Schaltkreise spielen wahrscheinlich eine Rolle bei der Koordination des visuell-räumlichen Verständnisses einer Uhr und frontostriatale Schaltkreise die exekutiven Funktionen, die zu einem akkuraten Ziffernblatt führen.
Perseveration
Perseveration ist definiert als die Fortsetzung oder Wiederholung von Aktivität ohne einen entsprechenden Stimulus. Beim Zeichnen von Uhren kann dies durch Perseveration von Zeigern (z. B. Vorhandensein von mehr als zwei Zeigern, was ein Versäumnis widerspiegelt, die laufende Reihe des Nachzeichnens der Zeiger zu beenden) oder Perseveration von Zahlen (z. B. abnormale Verlängerung von Zahlen, wie das Schreiben über 12 hinaus oder unangemessene Wiederholung derselben Zahlen) verursacht werden. Perseverationsfehler sind bei Alzheimer häufiger als bei normalen Probanden oder bei Patienten mit Schizophrenie.17,24 Perseverationsfehler beim Uhrzeichnen sind wahrscheinlich auf eine Beeinträchtigung der exekutiven Funktion im präfrontalen Bereich des Frontallappens zurückzuführen, die bei vielen Demenzerkrankungen zu finden ist.
Bildgebung
Verschiedene Arten von bildgebenden Befunden unterstützen die Beteiligung sowohl kortikaler als auch subkortikaler Regionen an der Ausführung der Aufgabe des Uhrzeichnens. In einer fMRT-Studie mit gesunden Personen, die eine Aufgabe ausführten, bei der Uhrzeiger gezeichnet werden mussten, um die Zeit anzuzeigen, wurden Aktivierungen sowohl in frontalen als auch in parietalen Regionen gefunden (Abbildung 2).2 In einer Studie mit Patienten mit MCI, bei der fMRT im Ruhezustand verwendet wurde, um die funktionelle Konnektivität des dorsolateralen präfrontalen Kortex (DLPFC) zu untersuchen, wurde berichtet, dass die Konnektivität zu mehreren Hirnregionen (z.B., (z.B. inferiorer parietaler Lobulus, superiorer frontaler Gyrus, medialer frontaler Gyrus, Putamen) reduziert war, aber nur die Reduktion der Konnektivität zwischen dem linken DLPFC und dem linken Thalamus korrelierte mit der Leistungsverschlechterung bei der Aufgabe, eine Uhr zu zeichnen (Abbildung 3).3 Eine Studie, die voxelbasierte Relaxometrie zur Identifizierung struktureller Schädigungen einsetzte, fand heraus, dass die Aufgabe, eine Uhr zu zeichnen, empfindlicher war als mehrere andere üblicherweise verwendete Tests (z.B, MMSE, Trailmaking Test Part A, Trailmaking Test Part B) auf das Vorhandensein kleinerer Hirnverletzungen hin, aber dass die Verletzungen an einer Vielzahl von kortikalen (Insula, temporal, frontal, posterior parietal) und subkortikalen (Corpus callosum, Caudate) Stellen auftraten.26 Eine andere Studie fand heraus, dass Anomalien der weißen Substanz in der periventrikulären Region stärker mit Leistungseinbußen verbunden waren als Anomalien der weißen Substanz in anderen Bereichen, was auf fronto-subkortikale Verbindungen hindeutet.27 In mehreren Studien wurde mit Hilfe der Positronen-Emissions-Tomographie (PET) und der Einzelphotonen-Emissions-Computertomographie (SPECT) der Zusammenhang zwischen lokalisierten Verminderungen des zerebralen Blutflusses oder der zerebralen Stoffwechselrate und Leistungseinbußen bei der Aufgabe des Uhrzeichnens bei verschiedenen Erkrankungen untersucht. Die am häufigsten assoziierten Areale bei Patienten mit Alzheimer oder MCI waren der parietale und der posteriore cinguläre Kortex sowie die Hippocampus-Region.28-30 Bei Patienten mit DLB-Demenz sind sowohl kortikale (frontal, temporoparietal) als auch subkortikale (Putamen, Thalamus) Regionen betroffen.31,32 Studien, die voxelbasierte Morphometrie bei Patienten mit Alzheimer oder MCI einsetzen, um die Beziehung zwischen lokaler Grauer-Materie-Dichte und der Leistung beim Zeichnen der Uhr zu beurteilen, haben Assoziationen mit zahlreichen kortikalen (temporal, frontal, parietal, Kleinhirn) und subkortikalen (Thalamus, Caudat) Bereichen berichtet.33-35 Bemerkenswert ist, dass eine Studie, die mehrere Bewertungssysteme verglich, herausfand, dass alle mit dem regionalen Volumen der grauen Substanz im rechten Scheitellappen korrelierten, sich aber für andere Bereiche unterschieden, was darauf hinweist, dass die Wahl des Bewertungssystems die Ergebnisse beeinflusst.34
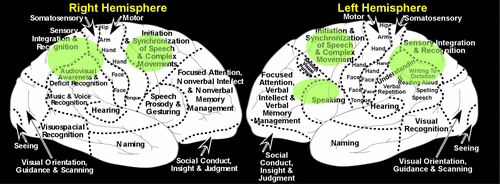
Abbildung 2. Illustrationen der linken und rechten Hemisphäre, die die Hauptfunktionen der kortikalen Regionen zusammenfassen.
Eine Studie mit funktioneller Magnetresonanztomographie (fMRT) an normalen, gesunden Personen kartierte die Bereiche, die durch den Handauflegeteil der Uhr-Zeichenaufgabe aktiviert wurden (ungefähre Bereiche in grün), was einen allgemeinen Hinweis auf die beteiligten kortikalen Netzwerke gibt.2
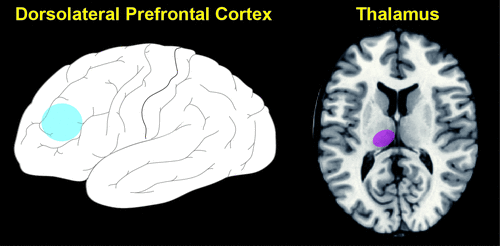
Abbildung 3. In einer aktuellen Studie wurde die funktionelle Konnektivität des dorsolateralen Areals des präfrontalen Kortex (ungefähre Lage in blau, DLPFC, BA 46) bei Patienten mit leichter kognitiver Beeinträchtigung (MCI) und gesunden Kontrollpersonen, die hinsichtlich Alter und Geschlecht gematcht wurden, mittels Ruhezustands-FMRT verglichen.3
In der MCI-Gruppe wies der DLPFC eine reduzierte Konnektivität mit mehreren kortikalen (inferiorer parietaler Lobulus, superiorer und medialer frontaler Gyri) und subkortikalen (Putamen, Thalamus) Arealen auf, was auf Veränderungen sowohl in den fronto-parietalen als auch in den fronto-striatal-thalamischen Schaltkreisen hinweist. Die beeinträchtigte Leistung beim Zeichnen einer Uhr in der MCI-Gruppe korrelierte mit einer reduzierten Konnektivität zwischen dem linken DLPFC und einem Areal im linken Thalamus (ungefähre Position in lila dargestellt). Wie die Autoren anmerken, deutet dieser Befund darauf hin, dass eine fronto-striatal-thalamische Diskonnektion zumindest teilweise den exekutiven Defiziten dieser Patienten zugrunde liegen könnte.
Nur eine Handvoll Studien hat die anatomischen Korrelate spezifischer Fehlertypen untersucht. Eine Studie über Läsionen/Defizite bei Patienten mit fokalen Hirnverletzungen identifizierte zwei vorherrschende Fehlermuster bei der Aufgabe, eine Uhr zu zeichnen.22 Probleme mit der räumlichen Organisation und der korrekten Platzierung von Zahlen traten häufiger bei Patienten mit Läsionen der rechten Hemisphäre auf, während Probleme mit der korrekten Platzierung der Uhrzeiger (Zeiteinstellung) häufiger bei Patienten mit Läsionen der linken Hemisphäre auftraten. Die Autoren dieser Studie merkten an, dass diese Ergebnisse mit einer gestörten visuospatialen Verarbeitung in der ersten Gruppe und einer gestörten Sprachverarbeitung in der zweiten Gruppe übereinstimmen. In einer Studie, in der die Auswirkungen einer hohen bzw. niedrigen Belastung durch periventrikuläre Anomalien der weißen Substanz (WMA) auf die Leistung des Uhrzeichnens bei Patienten mit Demenz untersucht wurden, wurden Patienten mit Alzheimer oder vaskulärer Demenz mit denen mit Parkinson hinsichtlich der Gesamtpunktzahl und der Punktzahl nach Funktionsbereichen (Grobmotorik, Zeit, Perseveration/Zug, räumliche Anordnung) verglichen.36 Die Gruppe mit niedriger WMA hatte eine bessere Leistung als die anderen beiden Gruppen (Parkinson; hohe WMA), die sich weder in der Gesamtpunktzahl noch in den Bereichswertungen unterschieden. Die Gruppe mit niedrigem WMA schnitt in der grobmotorischen Domäne besser ab als die Gruppe mit hohem WMA und besser als die Gruppe mit PD in den Domänen Zeit und räumliche Anordnung. Wie die Autoren anmerken, unterstützen diese Ergebnisse die Beteiligung sowohl kortikaler als auch subkortikaler Areale an der Ausführung dieser Aufgabe.
Schlussfolgerung
Die neuronalen Korrelate der Uhr-Zeichenleistung wurden hauptsächlich in klinischen Populationen mit Demenzerkrankungen untersucht, und nur wenige Studien haben spezifische Fehler untersucht. Daher gibt es noch viel zu lernen. Obwohl noch mehr Forschung nötig ist, um die funktionelle Neuroanatomie des Uhrenziehens besser zu verstehen, ist es klar, dass mehrere Hirnregionen in kortikalen und subkortikalen Bereichen und die Schaltkreise, die sie verbinden, eine Rolle spielen. Ein gestörtes Clock-Drawing kann ein Signal für eine kognitive Beeinträchtigung sein, das den Kliniker zu einem besseren Verständnis des Patienten und des Kontextes der vorliegenden Symptome führt. Der Kliniker kann das Uhrzeichnen auch als Mittel zur Überwachung kognitiver Veränderungen und als Lehrmittel für Familienangehörige und Studenten verwenden.
1 Rouleau I, Salmon DP, Butters N, et al: Quantitative und qualitative Analysen von Uhrzeichnungen bei der Alzheimer- und Huntington-Krankheit. Brain Cogn 1992; 18:70-87Crossref, Medline, Google Scholar
2 Ino T, Asada T, Ito J, et al.: Parieto-frontal networks for clock-drawing revealed with fMRI. Neurosci Res 2003; 45:71-77Crossref, Medline, Google Scholar
3 Liang P, Wang Z, Yang Y, et al.: Functional disconnection and compensation in mild cognitive impairment: evidence from DLPFC connectivity using resting-state fMRI. PLoS ONE 2011; 6:e22153Crossref, Medline, Google Scholar
4 Kaplan E: The process approach to neuropsychological assessment of psychiatric patients. J Neuropsychiatry Clin Neurosci 1990; 2:72-87Link, Google Scholar
5 Shulman KI: Clock-drawing: is it the ideal cognitive screening test? Int J Geriatr Psychiatry 2000; 15:548-561Crossref, Medline, Google Scholar
6 Pinto E, Peters R: Literature review of the Clock Drawing Test as a tool for cognitive screening. Dement Geriatr Cogn Disord 2009; 27:201-213Crossref, Medline, Google Scholar
7 Critchley M: The Parietal Lobes. Oxford, UK, Williams & Wilkins, 1966Google Scholar
8 Goodglass H, Kaplan E: The Assessment of Aphasia and Related Disorders. Osford, UK, Williams & Wilkins, 1972, pp vii-51Google Scholar
9 Goodglass H, Kaplan E: The Assessment of Aphasia and Related Disorders, 2nd Edition. Oxford, UK, Williams & Wilkins, 1983, pp vii-70Google Scholar
10 Edwin N, Peter JV, John G, et al: Zusammenhang zwischen Uhr- und Sternzeichen und dem Grad der hepatischen Enzephalopathie. Postgrad Med J 2011; 87:605-611Crossref, Medline, Google Scholar
11 Wagner PJ, Wortzel HS, Frey KL, et al: Clock-drawing performance predicts inpatient rehabilitation outcomes after traumatic brain injury. J Neuropsychiatry Clin Neurosci 2011; 23:449-453Link, Google Scholar
12 Writer BW, Schillerstrom JE, Regwan HK, et al: Executive clock-drawing correlates with performance-based functional status in people with combat-related mild traumatic brain injury and comorbid posttraumatic stress disorder. J Rehabil Res Dev 2010; 47:841-850Crossref, Medline, Google Scholar
13 Kitabayashi Y, Ueda H, Narumoto J, et al.: Qualitative Analysen von Uhrzeichnungen bei Alzheimer-Krankheit und vaskulärer Demenz. Psychiatry Clin Neurosci 2001; 55:485-491Crossref, Medline, Google Scholar
14 Blair M, Kertesz A, McMonagle P, et al: Quantitative und qualitative Analysen des Uhrenziehens bei frontotemporaler Demenz und Alzheimer-Krankheit. J Int Neuropsychol Soc 2006; 12:159-165Crossref, Medline, Google Scholar
15 Ryan JJ, Glass LA, Bartels JM, et al: Basisraten von „10 vor 11“-Uhren bei Alzheimer und Parkinson-Krankheit. Int J Neurosci 2009; 119:1261-1266Crossref, Medline, Google Scholar
16 Lee AY, Kim JS, Choi BH, et al: Charakteristika von Clock-Drawing Test (CDT) Fehlern nach Demenztyp: quantitative und qualitative Analysen. Arch Gerontol Geriatr 2009; 48:58-60Crossref, Medline, Google Scholar
17 Cahn DA, Salmon DP, Monsch AU, et al: Screening auf Demenz vom Alzheimer-Typ in der Gemeinde: der Nutzen des Clock-Drawing-Tests. Arch Clin Neuropsychol 1996; 11:529-539Crossref, Medline, Google Scholar
18 Rouleau I, Salmon DP, Butters N: Longitudinal analysis of clock drawing in Alzheimer’s disease patients. Brain Cogn 1996; 31:17-34Crossref, Medline, Google Scholar
19 Lee JH, Oh ES, Jeong SH, et al: Longitudinale Veränderungen in der Leistung des Clock-Drawing-Tests (CDT) in Abhängigkeit von Demenz-Subtypen und Schweregrad. Arch Gerontol Geriatr 2011; 53:e179-e182Crossref, Medline, Google Scholar
20 Lee KS, Kim EA, Hong CH, et al: Clock-drawing test in mild cognitive impairment: quantitative Analyse von vier Scoring-Methoden und qualitative Analyse. Dement Geriatr Cogn Disord 2008; 26:483-489Crossref, Medline, Google Scholar
21 Parsey CM, Schmitter-Edgecombe M: Quantitative and qualitative analyses of The Clock-Drawing Test in mild cognitive impairment and Alzheimer disease: evaluation of a modified scoring system. J Geriatr Psychiatry Neurol 2011; 24:108-118Crossref, Medline, Google Scholar
22 Tranel D, Rudrauf D, Vianna EP, et al: Hat der Clock Drawing Test fokale neuroanatomische Korrelate? Neuropsychology 2008; 22:553-562Crossref, Medline, Google Scholar
23 Budson AE: Understanding memory dysfunction. Neurologe 2009; 15:71-79Crossref, Medline, Google Scholar
24 Heinik J, Lahav D, Drummer D, et al: Vergleich eines Uhr-Zeichen-Tests bei älteren Patienten mit Schizophrenie und Alzheimer-Krankheit: eine Vorstudie. Int J Geriatr Psychiatry 2000; 15:638-643Crossref, Medline, Google Scholar
25 Cahn-Weiner DA, Williams K, Grace J, et al: Unterscheidung der Demenz mit Lewy-Körperchen von der Alzheimer-Krankheit und der Parkinson-Krankheit mit dem Uhr-Zeichen-Test. Cogn Behav Neurol 2003; 16:85-92Crossref, Medline, Google Scholar
26 Serber SL, Kumar R, Woo MA, et al.: Kognitive Testleistung und Hirnpathologie. Nurs Res 2008; 57:75-83Crossref, Medline, Google Scholar
27 Kim YS, Lee KM, Choi BH, et al: Zusammenhang zwischen dem Clock-Drawing Test (CDT) und strukturellen Veränderungen des Gehirns bei Demenz. Arch Gerontol Geriatr 2009; 48:218-221Crossref, Medline, Google Scholar
28 Nagahama Y, Okina T, Suzuki N, et al: Neuronale Korrelate der beeinträchtigten Leistung beim Uhr-Zeichen-Test bei Alzheimer-Krankheit. Dement Geriatr Cogn Disord 2005; 19:390-396Crossref, Medline, Google Scholar
29 Lee DY, Seo EH, Choo IH, et al: Neuronale Korrelate der Leistung des Clock-Drawing-Tests bei der Alzheimer-Krankheit: eine FDG-PET-Studie. Dement Geriatr Cogn Disord 2008; 26:306-313Crossref, Medline, Google Scholar
30 Takahashi M, Sato A, Nakajima K, et al: Schlechte Leistung im Clock-Drawing Test assoziiert mit visuellem Gedächtnisdefizit und reduzierten bilateralen hippocampalen und linken temporoparietalen regionalen Blutflüssen bei Alzheimer-Patienten. Psychiatry Clin Neurosci 2008; 62:167-173Crossref, Medline, Google Scholar
31 Nagahama Y, Okina T, Suzuki N, et al.: Zerebrale Substrate im Zusammenhang mit der beeinträchtigten Leistung im Uhrenzieh-Test bei Demenz mit Lewy-Körperchen. Dement Geriatr Cogn Disord 2008; 25:524-530Crossref, Medline, Google Scholar
32 Perneczky R, Drzezga A, Boecker H, et al.: Metabolische Veränderungen assoziiert mit einer gestörten Zeitmessung bei Lewy-Körper-Demenz. Psychiatry Res 2010; 181:85-89Crossref, Medline, Google Scholar
33 Thomann PA, Toro P, Dos Santos V, et al: Uhrenziehleistung und Hirnmorphologie bei leichter kognitiver Beeinträchtigung und Alzheimer-Krankheit. Brain Cogn 2008; 67:88-93Crossref, Medline, Google Scholar
34 Matsuoka T, Narumoto J, Shibata K, et al.: Neuronale Korrelate der Leistung bei verschiedenen Bewertungssystemen des Clock-Drawing-Tests. Neurosci Lett 2011; 487:421-425Crossref, Medline, Google Scholar
35 Han Y, Lui S, Kuang W, et al: Anatomische und funktionelle Defizite bei Patienten mit amnestischer leichter kognitiver Beeinträchtigung. PLoS ONE 2012; 7:e28664Crossref, Medline, Google Scholar
36 Cosentino S, Jefferson A, Chute DL, et al: Uhrenziehungsfehler bei Demenz: neuropsychologische und neuroanatomische Überlegungen. Cogn Behav Neurol 2004; 17:74-84Crossref, Medline, Google Scholar