WIE SIE DIESEN SNAPSHOT BENUTZEN
Die Informationen in den Schnappschüssen zeigen, wer an den klinischen Studien teilgenommen hat, die die FDA-Zulassung dieses Medikaments unterstützt haben, und ob es Unterschiede zwischen Geschlecht, Rasse und Altersgruppen gab. Die „MORE INFO“-Leiste zeigt detailliertere, technische Inhalte für jeden Abschnitt. Der Snapshot ist als ein Hilfsmittel für Verbraucher gedacht, um die Risiken und den Nutzen des Medikaments zu diskutieren.Inhalt eingeben
Beschränkungen dieses SNAPSHOT:
Verlassen Sie sich nicht auf Snapshots, um Entscheidungen bezüglich der medizinischen Versorgung zu treffen. Sprechen Sie immer mit Ihrem medizinischen Betreuer über die Risiken und den Nutzen eines Arzneimittels. Vollständige Informationen finden Sie in der Packungsbeilage von ENTRESTO.
ENTRESTO (Sacubitril/Valsartan)
(en-TRESS-toh)
Novartis Pharmaceuticals Corporation
Zulassungsdatum: 7. Juli 2015
Schnappschuss aus Medikamentenstudien:
Wogegen ist das Medikament?
ENTRESTO ist ein Arzneimittel, das in Verbindung mit anderen Therapien gegen Herzinsuffizienz zur Langzeitbehandlung der chronischen Herzinsuffizienz eingesetzt wird. Dabei handelt es sich um einen Zustand, bei dem das Herz geschwächt ist und nicht genügend Blut pumpen kann, um die Bedürfnisse des Körpers zu erfüllen.
ENTRESTO sollte nicht zusammen mit Medikamenten eingenommen werden, die zu bestimmten Medikamentenklassen gehören, die ACE-Hemmer und Angiotensin-Rezeptorblocker genannt werden. Das liegt daran, dass ENTRESTO selbst einen Angiotensin-Rezeptorblocker enthält.
Wie wird dieses Medikament angewendet?
ENTRESTO ist eine Tablette, die zweimal täglich durch den Mund eingenommen wird.
Was sind die Vorteile dieses Medikaments?
ENTRESTO reduzierte das Risiko von Todesfällen im Zusammenhang mit Herz und Blutgefäßen sowie von Krankenhausaufenthalten im Zusammenhang mit Herzinsuffizienz.
Was sind die Vorteile dieses Medikaments (Ergebnisse von Studien zur Bewertung der Wirksamkeit)?
Die folgende Tabelle fasst den primären Endpunkt zusammen. Der primäre Endpunkt war ein Kompositum, das das erste Ereignis von entweder kardiovaskulärem Tod oder Krankenhauseinweisung wegen Herzinsuffizienz maß. Sechs Patienten wurden falsch randomisiert und nicht behandelt, und 37 Patienten wurden in medizinischen Zentren eingeschlossen, in denen es Probleme bei der Durchführung der Studie gab. Diese 43 Patienten wurden nicht in die Analysen einbezogen.
Tabelle 2. Primärer Endpunkt, seine Komponenten, und All-Ursache Mortalität
| ENTRESTO N=4187 n (%) |
Enalapril N=4212 n (%) |
Gefährdungsverhältnis (95% CI) |
p-Wert | |
|---|---|---|---|---|
| Primärer zusammengesetzter Endpunkt kardiovaskulärer Tod oder Hospitalisierung wegen Herzinsuffizienz | 914 (22) | 1117 (27) | 0.80 (0.73, 0.87) |
<> |
|
377 (9) | 459 (11) | ||
|
537 (13) | 658 (16) | ||
| Anzahl der Probanden mit Ereignis* | ||||
|
558 (13) | 693 (17) | 0.80 (0,71, 0,89) |
|
|
537 (13) | 658 (16) | 0.79 (0.71, 0.89) |
|
| Gesamtmortalität | 711 (17) | 835 (20) | 0.84 (0.76, 0.93) |
0.0009 |
*Analysen der Komponenten des primären zusammengesetzten Endpunkts waren nicht prospektiv geplant, um für die Multiplizität bereinigt zu werden
**Einschließlich Probanden, die vor dem Tod eine Herzinsuffizienz-Hospitalisierung hatten
Quelle: ENTRESTO Verschreibungsinformationen, Abschnitt 14, Tabelle 2
Gab es Unterschiede in der Wirksamkeit des Medikaments in den klinischen Studien zwischen Geschlecht, Rasse und Alter?
Subgruppenanalysen wurden für Geschlecht, Rasse und Alter durchgeführt.
- Geschlecht: ENTRESTO wirkte bei Männern und Frauen ähnlich.
- Rasse: ENTRESTO wirkte bei allen untersuchten Rassen ähnlich.
- Alter: ENTRESTO wirkte bei allen untersuchten Altersgruppen ähnlich.
Gab es Unterschiede in der Wirksamkeit des Medikaments in den klinischen Studien zwischen den Geschlechtern, Rassen und Altersgruppen?
Die folgende Tabelle fasst die Ergebnisse des primären Endpunkts nach Untergruppen zusammen. Die Ergebnisse waren im Allgemeinen in den Untergruppen Geschlecht, Alter und Rasse ähnlich.
Tabelle 3. Untergruppenanalyse des primären Endpunkts
| Untergruppe | ENTRESTO | Enalapril | Gefährdungsquotient | 95% CI | ||||
|---|---|---|---|---|---|---|---|---|
| n (%) | Gesamt N | n (%) | Gesamt N | LL | UL | |||
| Gesamtansprechen/Alle Patienten | 914 (22) | 4187 | 1117 (27) | 4212 | 0.80 | 0.73 | 0.87 | |
| Geschlecht | ||||||||
| Männlich | 756 (23) | 3308 | 902 (28) | 3259 | 0.80 | 0.73 | ||
| Female | 158 (18) | 879 | 215 (23) | 953 | 0.76 | 0.62 | ||
| Altersgruppe | ||||||||
| ><> | 431 (20) | 2111 | 556 (26) | 2168 | 0.77 | 0.68 | 0.88 | |
| >=65 Jahre | 483 (23) | 2076 | 561 (27) | 2044 | 0.82 | 0.73 | ||
| >=75 Jahre | 208 (27) | 784 | 232 (30) | 779 | 0.86 | 0.72 | ||
| Rasse | ||||||||
| Weiß | 598 (22) | 2763 | 717 (26) | 2781 | 0.81 | 0.73 | ||
| Schwarz oder Afroamerikaner | 58 (27) | 213 | 72 (34) | 215 | 0.81 | 0.57 | ||
| Asiatisch | 179 (24) | 759 | 204 (27) | 750 | 0.85 | 0.70 | ||
| American Indian oder Alaska Native | 15 (18) | 84 | 22 (25) | 88 | 0.68 | 0.35 | ||
| Sonstiges | 64 (17) | 368 | 102 (27) | 378 | 0.63 | 0,46 | ||
Quelle: Klinische Studiendaten des Unternehmens und angepasst aus der ENTRESTO Verschreibungsinformation Abschnitt 14, Abbildung 4
Welche Nebenwirkungen sind möglich?
Die häufigsten Nebenwirkungen waren niedriger Blutdruck, hoher Kaliumspiegel im Blut, Husten, Schwindel und schlechte Nierenfunktion.
ENTRESTO kann ein ungeborenes Kind schädigen oder zum Tod führen und sollte daher von Schwangeren nicht eingenommen werden.
ENTRESTO kann eine allergische Reaktion, das sogenannte Angioödem, hervorrufen. Diese äußert sich in der Regel als Schwellung des Gesichts, der Lippen, der Zunge und des Rachens. Die Reaktion kann zu Atembeschwerden und zum Tod führen.
Was sind die möglichen Nebenwirkungen?
Die folgende Tabelle fasst die Nebenwirkungen zusammen. Die Studie umfasste 2 „Run-in“-Perioden, in denen die Patienten zeigen mussten, dass sie Enalapril (erster Run-in) und ENTRESTO (zweiter Run-in) gut genug vertragen, um in die randomisierte Phase der Studie überzugehen. Zwölf Prozent (12%) der Patienten brachen die „Run-in“-Phasen aufgrund von Nebenwirkungen ab; daher sind die unten gezeigten Nebenwirkungsraten niedriger als in der Praxis zu erwarten wäre. Die dargestellte Population sind alle Patienten, die mindestens eine Dosis ENTRESTO oder Enalapril während der randomisierten Phase der Studie erhalten haben.
Tabelle 4. Unerwünschte Wirkungen, die bei ≥5% der mit ENTRESTO behandelten Patienten auftraten (Doppel-Blindperiode)
| ENTRESTO (n = 4203) % |
Enalapril (n = 4229) % |
|
|---|---|---|
| Hypotonie | 18 | 12 |
| Hyperkaliämie | 12 | 14 |
| Husten | 9 | 13 |
| Schwindel | 6 | 5 |
| Nierenversagen/akutes Nierenversagen | 5 | 5 |
Quelle: ENTRESTO Verschreibungsinformation Abschnitt 6, Tabelle 1
Gab es Unterschiede bei den Nebenwirkungen zwischen Geschlecht, Rasse und Alter?
Subgruppenanalysen wurden für Geschlecht, Rasse und Alter durchgeführt.
- Geschlecht: Das Risiko für Nebenwirkungen schien bei Männern und Frauen ähnlich zu sein.
- Rasse: Es gab ein erhöhtes Risiko für eine allergische Reaktion namens Angioödem bei schwarzen Patienten.
- Alter: Das Risiko für niedrigen Blutdruck war bei Patienten ab 65 Jahren höher.
Gab es Unterschiede bei den Nebenwirkungen in den klinischen Studien zwischen den Geschlechtern, Rassen und Altersgruppen?
Die folgende Tabelle fasst die Angioödeme nach Untergruppen zusammen. Angioödeme traten unter ENTRESTO häufiger auf als unter Enalapril in allen Gruppen und waren häufiger bei Schwarzen.
Tabelle 6. Subgruppenanalyse von Angioödemen in der Sicherheitspopulation*
| Untergruppe | ENTRESTO (N=4203) n(%) |
Enalapril (N=4229) |
Relatives Risiko | 95% CI | |||
|---|---|---|---|---|---|---|---|
| n (%) | Gesamt, m | n (%) | Gesamt, m | LL | UL | ||
| Ein Angioödem | 19 (<1) | 4203 | 10 (<1) | 4229 | 1.91 | 0.89 | 4.11 |
| Geschlecht | |||||||
| Männlich | 12 (<1) | 3316 | 8 (<1) | 3270 | 1.48 | 0.61 | 3.61 |
| Female | 7 (1) | 887 | 2 (<1) | 959 | 3.78 | 0.79 | 18.17 |
| Altersgruppe | |||||||
| ><65 | 12 (1) | 2120 | 6 (<1) | 2174 | 2.05 | 0.77 | 5.45 |
| >=65 Jahre | 7 (<1) | 2083 | 4 (<1) | 2055 | 1.73 | 0.51 | 5.89 |
| >=75 Jahre | 1 (<1) | 786 | 2 (<1) | 783 | 0.50 | 0.05 | 5.48 |
| Rasse | |||||||
| Weiß | 10 (<1) | 2777 | 5 <1) | 2796 | 2.01 | 0.69 | 5.88 |
| Schwarz oder Afroamerikaner | 5 (2) | 213 | 1 (<1) | 214 | 5.02 | 0.59 | 42.64 |
| Asiatisch | 3 (<1) | 757 | 2 (<1) | 750 | 1.49 | 0.25 | 8.87 |
| American Indian oder Alaska Native |
0 | 84 | 0 | 88 | NE** | NE** | NE** |
| Andere | 1 (<1) | 372 | 2 (1) | 381 | 0.51 | 0,05 | 5,61 |
*Sicherheitspopulation=jeder Patient, der mindestens eine Dosis des Studienmedikaments erhielt.
**NE=nicht auswertbar
Quelle: Company Clinical Trial Data
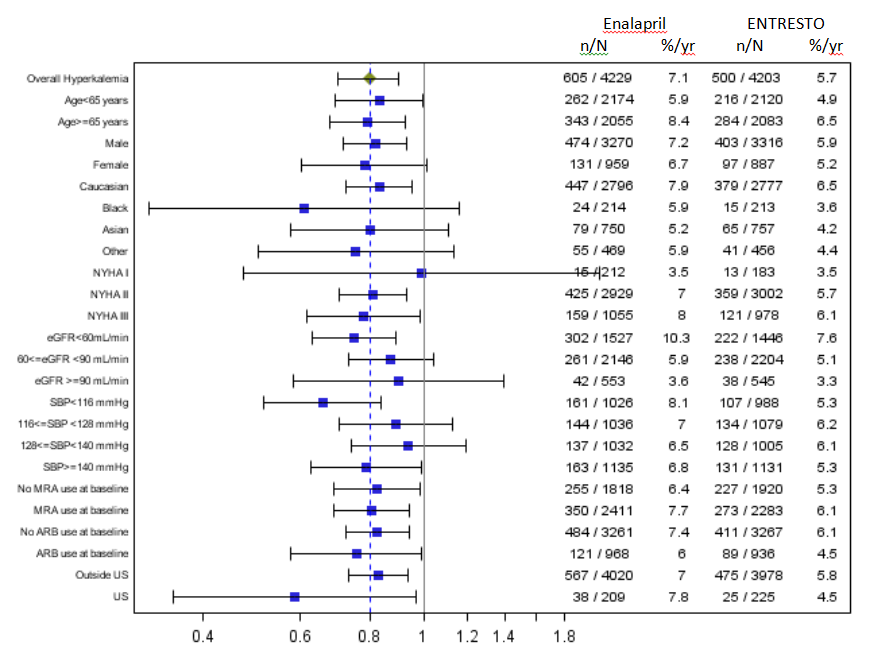
Die folgende Abbildung fasst die Hyperkaliämie nach Untergruppen zusammen. Die Häufigkeit der Hyperkaliämie war nach Geschlecht, Rasse und Alter ähnlich.
Abbildung 4. Subgruppenanalyse der Hyperkaliämie (Sicherheitspopulation)
Quelle: FDA Review
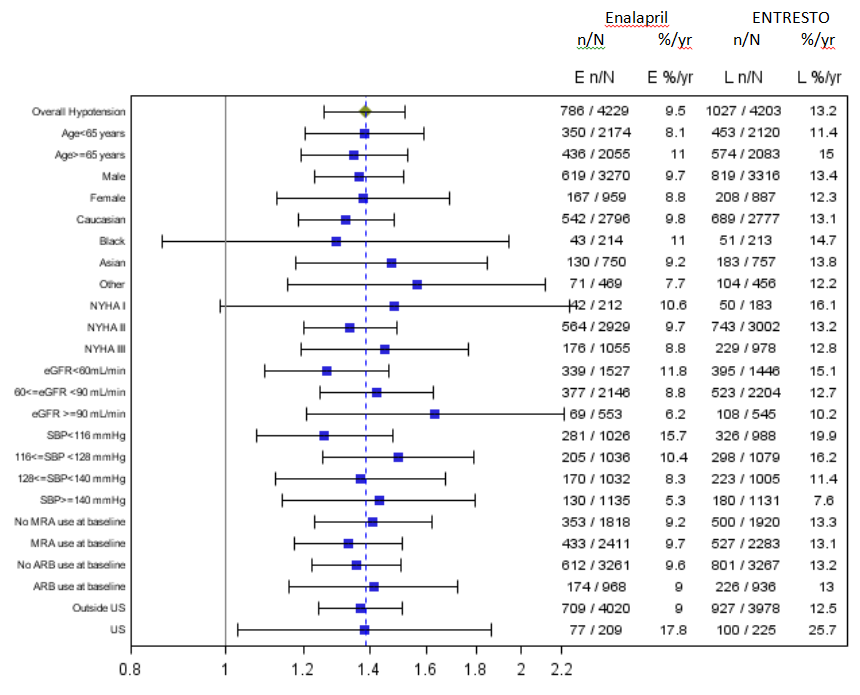
Die folgende Abbildung fasst die Hypotonie nach Untergruppen zusammen. Hypotonie wurde häufiger bei Patienten über 65 Jahren beobachtet.
Abbildung 5. Hypotension nach Untergruppe (Sicherheitspopulation)
Quelle: FDA Review
Wer hat an den klinischen Studien teilgenommen?
Wer hat an den klinischen Studien teilgenommen?
Die FDA hat ENTRESTO aufgrund der Ergebnisse einer klinischen Studie zugelassen, an der 8442 Patienten mit chronischer Herzinsuffizienz teilnahmen. Die Studie wurde in den Vereinigten Staaten, Kanada, West- und Mitteleuropa, Lateinamerika und Asien durchgeführt. Die gleiche Studie wurde verwendet, um den Nutzen und die Nebenwirkungen des Medikaments zu bewerten.
Die folgende Abbildung fasst zusammen, wie viele Männer und Frauen in die klinische Studie aufgenommen wurden.
Abbildung 1. Demografische Ausgangsdaten nach Geschlecht
Quelle: Company Clinical Trial Data
Die folgende Abbildung und Tabelle fassen zusammen, wie viele Patienten nach Rasse in die klinische Studie aufgenommen wurden.
Abbildung 2. Demographische Ausgangsdaten nach Rasse
*Andere: alle anderen Rassen zusammen
Quelle: Klinische Studiendaten des Unternehmens
Tabelle 1. Demografische Ausgangsdaten nach Rasse
| Rasse | Anzahl der Patienten | Anteil der Patienten | |
|---|---|---|---|
| Weiß | 5579 | 66 | |
| Asiatisch | 1510 | 18 | |
| Andere | 753 | 9 | |
| Schwarz oder Afroamerikaner | 428 | 5 | |
| American Indian oder Alaska Native | 172 | 2 |
Quelle: Klinische Studiendaten des Unternehmens
Abbildung 3. Demografische Ausgangsdaten nach Alter
Quelle: Company Clinical Trial Data
Wer hat an den Studien teilgenommen?
Die folgende Tabelle fasst die demografischen Ausgangsdaten der randomisierten Population zusammen.
Tabelle 7. Basisdemographie (Randomisierte Population)
| Behandlung Gruppen | |||
|---|---|---|---|
| Demographische Parameter | ENTRESTO (N=4209) n (%) |
Enalapril (N=4233) n (%) |
Gesamt (N=8442) n (%) |
| Geschlecht | |||
| Männlich | 3321 (79) | 3274 (77) | 6595 (78) |
| Weiblich | 888 (21) | 959 (23) | 1847 (22) |
| Alter (Jahre) | |||
| Mittelwert (SD) | 64 (11.5) | 64 (11.2) | 64 (11.4) |
| Median | 64 | 64 | 64 |
| (Min, Max) | 18, 96 | 21, 96 | 18, 96 |
| Altersgruppe | |||
| 18 bis <65 | 2122 (50) | 2177 (51) | 4299 (51) |
| >=65 | 2087 (50) | 2056 (49) | 4142 (49) |
| >=75 | 786 (19) | 783 (19) | 1569 (19) |
| Rasse | |||
| weiß | 2780 (66) | 2799 (66) | 5579 (66) |
| Schwarz oder Afroamerikaner | 213 (5) | 215 (5) | 428 (5) |
| Indianer oder Alaskaner | 84 (2) | 88 (2) | 172 (2) |
| asiatisch | 760 (18) | 750 (18) | 1510 (18) |
| Andere | 372 (9) | 381 (9) | 753 (9) |
| Ethnizität | |||
| Hispanisch oder Latino | 777 (18) | 778 (18) | 1555 (18) |
| Nicht hispanisch oder Latino | 3432 (82) | 3455 (82) | 6887 (82) |
| Region | |||
| Vereinigte Staaten | 225 (5) | 209 (5) | 434 (5) |
| Kanada | 85 (2) | 83 (2) | 168 (2) |
| Mitteleuropa | 1398 (33) | 1439 (34) | 2837 (34) |
| Westeuropa Europa | 1029 (24) | 1028 (24) | 2057 (24) |
| Asien/Pazifik/Sonstiges | 746 (18) | 742 (18) | 1488 (18) |
| Lateinamerika | 726 (17) | 732 (17) | 1458 (17) |
Quelle: Company Clinical Trial Data
Wie waren die Studien angelegt?
Es gab eine Studie, die den Nutzen und die Nebenwirkungen von ENTRESTO untersuchte. In der Studie wurden Patienten mit Herzinsuffizienz nach dem Zufallsprinzip entweder ENTRESTO oder ein zugelassenes Medikament namens Enalapril zugewiesen. Weder die Patienten noch die medizinischen Betreuer wussten, welche Behandlung verabreicht wurde, bis die Studie abgeschlossen war.
Die Studie verglich Patienten, die ENTRESTO erhielten, mit Patienten, die Enalapril einnahmen, indem sie die Anzahl der Patienten maß, die an einer Ursache starben, die mit dem Herzen oder den Blutgefäßen zusammenhing, oder die wegen Herzversagen ins Krankenhaus eingeliefert wurden.
Wie waren die Studien aufgebaut?
Eine multinationale, randomisierte, doppelblinde Studie wurde zum Vergleich von ENTRESTO und Enalapril bei 8442 erwachsenen Patienten mit symptomatischer chronischer Herzinsuffizienz (New York Heart Association Klasse II-IV) und systolischer Dysfunktion (linksventrikuläre Ejektionsfraktion ≤40%) durchgeführt. Die Patienten mussten seit mindestens vier Wochen einen Angiotensin-Converting-Enzym (ACE)-Hemmer oder Angiotensin-Rezeptor-Blocker (ARB) und maximal verträgliche Dosen von Betablockern erhalten haben. Die Studie umfasste zwei „Run-in“-Perioden, in denen die Patienten zeigen mussten, dass sie Enalapril (erster Run-in) und ENTRESTO (zweiter Run-in) gut genug vertragen, um in die randomisierte Phase der Studie zu gelangen.
Der primäre Endpunkt war das erste Ereignis für das Kompositum aus kardiovaskulärem Tod oder Krankenhausaufenthalt wegen Herzinsuffizienz.
GLOSSAR
KLINISCHE STUDIEN: Freiwillige Forschungsstudien, die an Menschen durchgeführt werden und der Beantwortung spezifischer Fragen zur Sicherheit oder Wirksamkeit von Arzneimitteln, Impfstoffen, anderen Therapien oder neuen Möglichkeiten der Anwendung bestehender Behandlungen dienen.
KOMPARATOR: Eine zuvor verfügbare Behandlung oder ein Placebo, das in klinischen Studien verwendet wird und mit dem eigentlichen zu testenden Arzneimittel verglichen wird.
WIRKUNG: Wie gut das Arzneimittel die gewünschte Reaktion erzielt, wenn es wie beschrieben in einer kontrollierten klinischen Umgebung, wie z. B. während einer klinischen Studie, eingenommen wird.
PLACEBO: Eine inaktive Substanz oder „Zuckerpille“, die genauso aussieht wie ein aktives Medikament oder eine Behandlung, die getestet wird, und die auf die gleiche Weise verabreicht wird. Die Wirkungen des aktiven Medikaments oder der Behandlung werden mit den Wirkungen des Placebos verglichen.
SUBGROUP: Eine Untergruppe der in einer klinischen Studie untersuchten Bevölkerung. Zu den demografischen Untergruppen gehören Geschlecht, Rasse und Altersgruppen.
VORSCHRIFTEN
Zurück zu den Schnappschüssen von Medikamentenstudien