Dysocjacja to rozpad związku na elementy
Słowa dysocjować i dysasocjować mają podobne znaczenie – usuwać z połączenia.
Gdy związek dysocjuje, wiązania zostają zerwane.
Dysocjacja związków jonowych
Wszystkie związki jonowe dysocjują w pewnym stopniu, gdy rozpuszczają się w wodzie.
Związki jonowe to takie związki, które składają się z atomów zwanych jonami o przeciwnych ładunkach.
Gdy związek jonowy dysocjuje w wodzie, wiązanie jonowe zostaje zerwane.
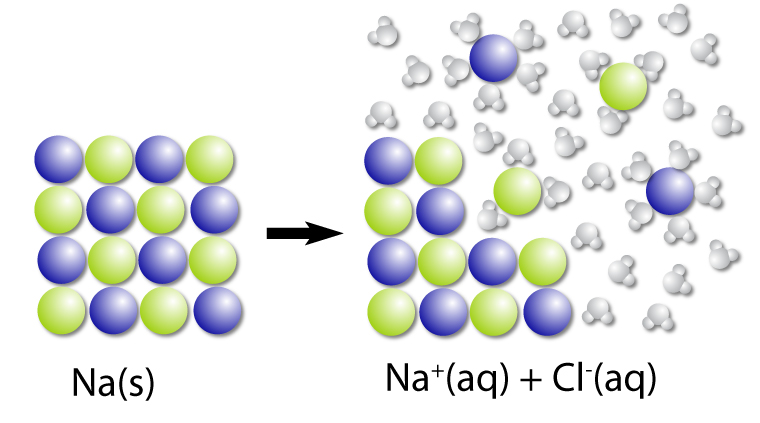
Dysocjacja NaCl

Stały chlorek sodu rozpuszcza się w wodzie, tworząc jony Na+ i Cl-.
Dysocjację NaCl można zapisać jako:
NaCl(s) → Na+(aq) i Cl-(aq)
- (s) reprezentuje stan stały
- (aq) reprezentuje roztwór wodny
- Roztwór wodny to roztwór, którego rozpuszczalnikiem jest woda
Dysocjacja związków kowalencyjnych
Ogólnie, związki kowalencyjne nie dysocjują, gdy są rozpuszczone w wodzie. Jest to prawdą w większości przypadków. Istnieją jednak pewne związki kowalencyjne (takie jak kwasy chlorowodorowe), które dysocjują po rozpuszczeniu w wodzie.
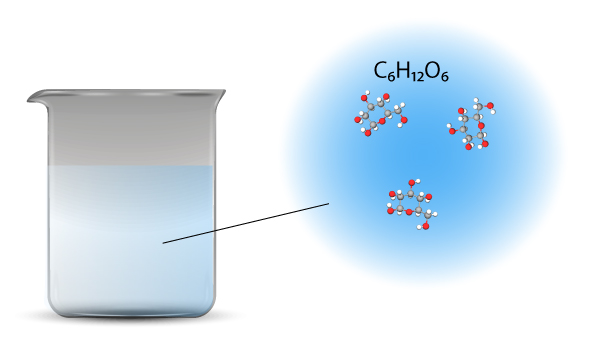
Glukoza jest związkiem kowalencyjnym. Po rozpuszczeniu w wodzie nie ulega dysocjacji. W wodzie cząsteczki ulegają rozdzieleniu – oddalają się od siebie, ale nie dochodzi do zerwania wiązań. Każda cząsteczka glukozy pozostaje w wodzie jako cała jednostka.
For more reading, please refer to sodium chloride dissociation in the process of solvation.