El viaje que el astrónomo francés Pierre Janssen emprendió desde Europa hasta la provincia india oriental de Madrás durante la primavera de 1868 no fue una empresa de un día para otro. Janssen recorrió medio mundo con la esperanza de ser la primera persona en observar el próximo eclipse de sol utilizando un nuevo instrumento científico llamado espectroscopio. Con este nuevo instrumento, esperaba hacer nuevos descubrimientos sobre la composición del Sol, siempre y cuando las densas nubes no estropearan su visión.
Durante su viaje, y la preocupante racha de lluvias que precedió al día del eclipse, Janssen habría tenido mucho tiempo para reflexionar sobre los gigantes científicos sobre cuyos hombros esperaba estar. El descubrimiento que puso en marcha la misión de Janssen fue la famosa observación de Newton en 1666 de que un rayo de luz solar, al pasar por un prisma de cristal, se convierte en un arco iris de colores. La luz blanca, demostró Newton, era una mezcla de todos los demás colores combinados. Sin embargo, a medida que las técnicas de dispersión de la luz solar fueron mejorando, el espectro solar resultó no ser la perfecta gama de colores que parecía al principio. En 1814, el físico y fabricante de lentes alemán Josef von Fraunhofer dirigió la luz solar a través de una estrecha hendidura antes de hacerla pasar por un prisma de cristal, y demostró que el arco iris de Newton estaba plagado de agujeros.
Fue el primer vistazo a un nuevo elemento
La configuración de la delgada rendija de Fraunhofer dispersó la luz del sol con más eficacia de la que podría conseguir un prisma por sí solo, revelando así nada menos que 574 líneas nítidas y oscuras en el espectro solar. Pero no fue hasta 1859 cuando sus compatriotas Robert Bunsen y Gustav Kirchhoff descubrieron a dónde habían ido a parar las longitudes de onda que faltaban (véase Chemistry World, septiembre de 2013, p35). Kirchhoff inventó un instrumento basado en un prisma -el espectroscopio- que el dúo utilizó para demostrar que algunas de las líneas oscuras de la luz solar coincidían exactamente con el patrón característico de líneas de la luz emitida cuando se quemaban en una llama las sales de metales recién descubiertos, como el sodio y el potasio.
Los científicos demostraron que cada elemento absorbía y emitía su propio patrón de longitudes de onda, tan único como una huella dactilar, un efecto que ahora sabemos que está causado por los electrones que absorben o liberan luz para saltar excitados entre estados de energía. Bunsen y Kirchhoff habían demostrado que el Sol estaba compuesto por los mismos elementos químicos que la Tierra. Utilizando el espectroscopio de Kirchhof, descubrieron dos elementos desconocidos, el rubidio y el cesio, quemando residuos de muestras de agua mineral.
La carrera por encontrar más elementos nuevos utilizando el espectroscopio se inició, lo que llevó, en 1868, a la misión de Janssen de apuntar uno al Sol. Al realizar su experimento durante un eclipse, Janssen esperaba ver los elementos presentes alrededor de la franja del Sol, en su atmósfera.
El día del eclipse, las nubes finalmente se dispersaron. Cuando el eclipse comenzó y la oscuridad descendió sobre Madrás aquel 18 de agosto, Janssen vio las ya conocidas líneas de emisión del hidrógeno caliente, así como una línea amarilla brillante nunca antes vista. Se trataba de un primer vistazo a un nuevo elemento, concluyó Janssen.
Como pronto se comprobó, no hacía falta un eclipse solar para ver esta llamativa línea amarilla. Un día nublado de otoño en la ciudad universitaria británica de Cambridge también serviría. El 20 de octubre de ese año, sin conocer las observaciones de Janssen, el astrónomo inglés Norman Lockyer también vio la línea amarilla y decidió llamar a este desconocido elemento químico helio, en honor a la palabra griega para el sol, helios.
Los documentos de los dos hombres sobre sus observaciones llegaron a la Academia Francesa de Ciencias de París el mismo día, por lo que compartieron el mérito de haber descubierto un nuevo elemento.
A partir de ahí comenzaron varias décadas de problemas para la pareja.
Ampliación de la tabla periódica
No todo el mundo estaba convencido de que Janssen y Lockyer hubieran descubierto un nuevo elemento químico en los márgenes del Sol. Algunos científicos acogieron la idea del elemento celeste con un ridículo absoluto, que no hizo más que aumentar a medida que pasaban los años y no se encontraba ningún rastro de helio en la Tierra. Incluso el propio asistente de Lockyer pensó que la línea amarilla era una emisión de hidrógeno probablemente no detectada anteriormente.1
Fuente: © Royal Society of Chemistry
William Ramsay encontró el helio en la Tierra – y el criptón, el neón y el xenón
Entre los no creyentes destacaba un oponente bastante formidable, Dimitrii Mendeleev. El químico ruso no era ajeno a la hostilidad y la burla, ya que estuvo en el punto de mira durante más de media década tras la publicación de su tabla periódica en 1869. Pero para Mendeléyev, la reivindicación espectacular de su descubrimiento llegó en 1875, cuando -utilizando un espectroscopio- Paul-Emile Lecoq de Boisbaudran descubrió el galio, un elemento cuyo peso atómico encajaba perfectamente en un hueco de la tabla. Poco después, los descubrimientos del escandio y el germanio cubrieron otros huecos. Pero ninguno de estos descubrimientos ayudó al helio, porque la tabla periódica de la época no tenía ningún hueco para el helio.
Era una omisión que volvería a perseguir a Mendeléyev. En 1894, el químico inglés William Ramsay descubrió un gas no reactivo, que denominó argón, liberado al calentar una muestra de un mineral. Sin saber qué hacer con este nuevo elemento que su tabla periódica no había predicho, Mendeléiev argumentó que Ramsay no había descubierto un nuevo elemento, sino una molécula de nitrógeno de tres átomos no observada hasta entonces, parecida al ozono (O3).
Pero en 1895, repitiendo el experimento de calentamiento con un mineral de uranio, Ramsay aisló otro gas inerte. Éste produjo una línea espectral que coincidía exactamente con las que Janssen y Lockyer habían observado en el Sol. Ramsay había encontrado helio en la Tierra. Ramsay no tardó en descubrir el criptón, el neón y el xenón, todos ellos notablemente poco reactivos. Este nuevo conjunto de elementos convenció a Mendeléyev de que era necesario ampliar la tabla periódica.
Los gases nobles, encabezados por el helio, se sitúan ahora en el extremo derecho de la tabla, una posición que refleja su cáscara exterior de electrones perfectamente rellena. Esta disposición tan estable de los electrones es la razón de que estos elementos tengan una reactividad química notablemente baja, siendo el helio el elemento menos reactivo de todos.
El descubrimiento por parte de Ramsay de toda una nueva familia de elementos que necesitaban ser atornillados al lado derecho de la tabla periódica le valió el premio Nobel de Química de 1904. Ese mismo descubrimiento, según algunos, echó por tierra simultáneamente las posibilidades del propio Mendeléyev de ganar el premio.1 A pesar de su notable contribución a la ciencia, el químico ruso nunca recibió el Nobel.
Arriba y lejos
No fue un afortunado accidente que Ramsay aislara el helio de un mineral rico en uranio. Es la lenta desintegración de los núcleos radiactivos de uranio y torio la principal fuente de helio del planeta en la actualidad. Varios isótopos de uranio y torio se desintegran emitiendo partículas alfa, un pequeño grupo de partículas subatómicas formado por dos protones y dos neutrones. Esta combinación de partículas subatómicas es el mismo conjunto que compone el núcleo del helio.
En todo el universo, el helio es el segundo elemento más común después del hidrógeno. La mayor parte de este helio se origina en un breve período de un par de minutos después del Big Bang, cuando las temperaturas se enfriaron lo suficiente como para que pequeños grupos de partículas subatómicas formaran los primeros núcleos atómicos. Unos 380.000 años después, el universo se enfrió finalmente lo suficiente como para que estos núcleos capturaran electrones, formando los primeros átomos -principalmente el hidrógeno y el helio, que aún hoy dominan el universo.
En la Tierra, sin embargo, la historia es diferente. El helio es tan ligero que no está sujeto por la gravedad de la Tierra. Al ser inerte, tampoco lo sujeta la química. El helio presente cuando la Tierra se estaba formando se ha desviado hacia el espacio. Júpiter y Saturno, planetas más grandes y con mayor gravedad, conservaron su helio y es un componente importante de la composición de los gigantes gaseosos. Como observaron Lockyer y Janssen, también es un componente importante de la atmósfera del Sol.
Cuando Ramsay descubrió los gases nobles, algunos miembros de la familia encontraron rápidamente usos. Uno de los primeros experimentos que el químico realizó con el neón recién aislado en sus laboratorios del University College de Londres fue excitarlo con un electrodo. El gas desprendía un impresionante resplandor rojo que pronto iluminó las calles de París y Los Ángeles en forma de carteles publicitarios.

Fuente: © Michael Helliwell/Alamy Stock Photo
¿Los dirigibles tienen que volver?
El helio tardó un poco más en encontrar un uso. El proceso se vio acelerado por el estallido de la primera guerra mundial.2 Los globos militares de los zepelines alemanes centraron la atención de los militares británicos y estadounidenses en los gases más ligeros que el aire. El helio no podía igualar el poder de elevación del hidrógeno, pero tenía la clara ventaja de que era químicamente inerte y no se quemaba si era alcanzado por el fuego enemigo. Una década antes del estallido de la guerra, se descubrió que el helio estaba presente de forma natural en algunos depósitos de gas natural, especialmente en Texas. Cuando EE.UU. entró en la guerra, la Oficina de Minas firmó contratos para la construcción de tres plantas de extracción de helio.
Los dirigibles pronto fueron sustituidos por los aviones para los vuelos militares y comerciales, por lo que el uso del helio como gas más ligero que el aire no despegó como se esperaba, aunque hoy en día se utiliza para llenar globos para la investigación científica a gran altura, así como para globos de fiesta. Durante décadas, Estados Unidos produjo mucho más helio del que utilizaba, que acorraló bajo tierra en yacimientos de gas agotados.
En 1996, para recuperar la considerable deuda que había acumulado comprando y almacenando todo este helio, el gobierno estadounidense anunció una gran venta del gas almacenado, para gran preocupación de los científicos. En ese momento, la demanda de helio se disparó. Su naturaleza inerte había hecho que se utilizara para crear una atmósfera protectora en la fabricación de fibras ópticas y semiconductores, y para la soldadura por arco, por ejemplo. Y lo que es más importante, el helio se ha convertido en un elemento indispensable para la moderna maquinaria de imagen médica y para ayudarnos a explorar los profundos misterios del cosmos. Dado que el helio tiene el punto de ebullición más bajo de todos los elementos, un ultrafrío de -269°C, es un refrigerante esencial para las bajísimas temperaturas que necesitan los electroimanes superconductores utilizados en las máquinas de resonancia magnética de los hospitales. Por la misma razón, enfría los imanes del Gran Colisionador de Hadrones, así como algunas máquinas de RMN.
Una vez que el helio se escapa al aire, este gas ligero desaparece para siempre. En 2015, la Asociación Médica Británica estaba preocupada porque pronto habría que regular el suministro de helio para garantizar el abastecimiento del gas a medio y largo plazo. Pero ese año, un equipo de las universidades británicas de Oxford y Durham, en colaboración con la empresa de exploración de helio Helium One, utilizó un nuevo método de búsqueda sistemática para descubrir por primera vez un recurso natural de helio.

Fuente: Noel Feans (Oldupai) / CC BY 2.0
La tan discutida escasez de helio podría evitarse extrayendo el gas del Valle del Rift de Tanzania
El enorme hallazgo de helio se encuentra en el Valle del Rift en Tanzania, donde se habían identificado por primera vez filtraciones de helio en la década de 1950. El equipo utilizó técnicas de exploración petrolífera, evaluando factores como el tipo de roca, pero demostró que la clave para adaptar las técnicas a la exploración de helio era tener en cuenta la presencia de volcanes activos cercanos. La actividad volcánica probablemente proporciona el calor necesario para liberar el helio acumulado en las antiguas rocas de la corteza terrestre», explica Diveena Danabalan, miembro del equipo de Durham. Sin embargo, la ubicación del volcán tiene una dimensión de «ricitos de oro», añade. ‘Si las trampas de gas están demasiado cerca de un determinado volcán, corren el riesgo de que el helio quede muy diluido por gases volcánicos como el dióxido de carbono’.
Algunos de los gases atrapados que el equipo ha muestreado tienen entre un 8% y un 10% de helio, una proporción muy superior a la de los yacimientos de helio que se explotan actualmente.3 Según Helium One, las estimaciones actuales sitúan la cantidad de helio presente en los yacimientos del Valle del Rift estudiados hasta ahora en casi 100.000 millones de pies cúbicos (2.800 millones de metros cúbicos), no muy lejos de la actual reserva estadounidense de 153.000 millones de pies cúbicos.
La inminente crisis del helio parece haberse evitado, por ahora.
Bajo presión
Cuando se trata de química, el helio no deja mucho que contar. El helio es el elemento menos reactivo de la tabla periódica, ya que posee un potencial de ionización récord y su afinidad por los electrones es prácticamente nula. Mientras que otros miembros de los gases nobles han sido engatusados para que se sometan a algún tipo de química, especialmente con elementos muy electronegativos como el flúor, el helio se ha resistido, hasta hace poco.
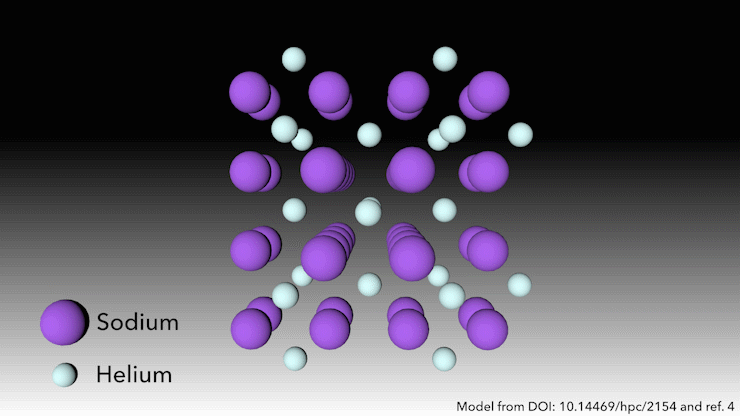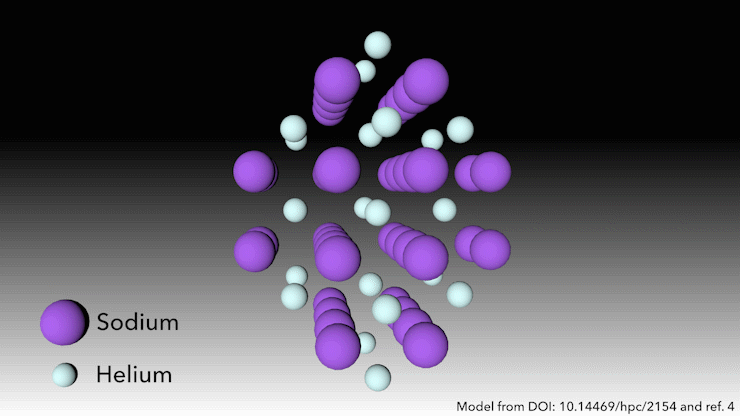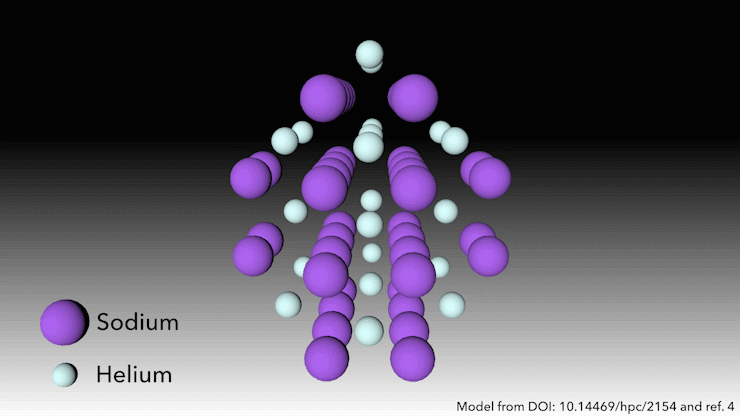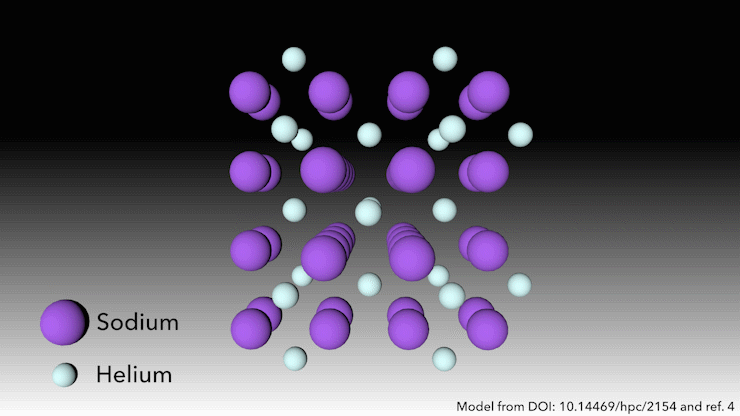
¿Quién dice que el helio no forma compuestos?
En 2017, un equipo internacional demostró que el helio formará un compuesto estable en estado sólido cuando se mezcle con sodio4. Solo hay que apretarlo lo suficiente. ‘A presiones muy altas, ocurre algo extraño’, dice Richard Dronskowski, de la Universidad de Aquisgrán (Alemania), que formó parte del equipo. A presiones de más de 113 gigapascales -más de un millón de atmósferas- los átomos de sodio de la estructura se aprietan tanto que escupen su electrón de valencia. El catión de sodio es mucho más pequeño que el átomo de sodio, pero entonces la pregunta es: ¿dónde ponemos el electrón? dice Dronskowski. Ahí es donde entran los átomos de helio. El helio es el espaciador: no acepta electrones, pero mantiene el catión de sodio y el electrón cargado negativamente alejados el uno del otro». Los pares de electrones se asientan en agujeros en la estructura que los átomos de helio ayudan a crear.
Este extraño compuesto de helio, que tiene la fórmula Na2He, es el primer ejemplo de un material en estado sólido en el que un átomo actúa como espaciador para ayudar a desproporcionar un átomo en un catión y un electrón, dice Dronskowski. Pero en otros aspectos, el material es bastante familiar, añade. En pocas palabras, es una sal como la de mesa. Adopta una estructura cristalina muy conocida en la química del estado sólido.’
Y el helio -supuestamente totalmente inerte- sigue sorprendiendo y dando lugar a nuevos tipos de química. Fueron las predicciones por ordenador -mucho más fáciles de realizar que los costosos y largos experimentos a alta presión- las que sugirieron por primera vez que podría existir el Na2He. Los nuevos cálculos muestran que el helio podría formar toda una serie de compuestos, algunos de los cuales podrían ser estables a presiones tan bajas como 30 gigapascales.5
Más allá de nuestro sistema solar
Explorar el cosmos, estudiar la química lejana buscando la huella reveladora de las líneas espectrales en la luz que llega a la Tierra, es un tema de investigación tan candente hoy como lo era en la época de Janssen y Lockyer.
Exactamente 150 años después de que los dos astrónomos descubrieran la línea de emisión amarilla brillante que supuso el primer atisbo de helio para la humanidad, un equipo de investigadores dirigido por el Reino Unido ha identificado por primera vez el helio en la atmósfera de un exoplaneta6. El proceso que utilizamos nosotros y que utilizó Lockyer es, en realidad, bastante similar», afirma Jessica Spake, de la Universidad de Exeter, que dirigió la investigación. ‘La línea amarilla que Lockyer encontró, y la que nosotros encontramos en el infrarrojo cercano, ambas provienen del helio excitado.’

Los científicos han encontrado helio en la atmósfera que escapa del exoplaneta WASP-107b
Aunque se esperaba ampliamente que el helio estuviera presente en la atmósfera de los planetas que orbitan alrededor de soles lejanos -como lo está dentro de las atmósferas planetarias de nuestro propio sistema solar- dos obstáculos nos habían impedido detectarlo, explica Spake. En primer lugar, hay pocos detectores que funcionen en el espectro del infrarrojo cercano. Y en segundo lugar, las moléculas de agua de la atmósfera terrestre tienen líneas de emisión que ocultan la señal del helio. Ha sido una región de longitud de onda un poco difícil de trabajar», dice Spake. Como resultado, la búsqueda de helio pasó de moda.
El estudio de Spake vuelve a poner el elemento en boga. Utilizando el detector de infrarrojo cercano del telescopio espacial Hubble, Spake detectó la señal de helio cuando el exoplaneta WASP-107b pasó por delante de su estrella y parte de la luz de ésta atravesó la atmósfera superior del planeta, rica en helio. Esa luz estelar transportó la banda de emisión característica del helio hasta la Tierra.
«Lo emocionante es que muchos espectrógrafos de alta resolución que cubren esta longitud de onda van a entrar en funcionamiento el próximo año, así que ahora es el momento perfecto para buscar helio», dice Spake. Creemos que podemos hacer mucha ciencia con este nuevo método de estudio de las atmósferas de los exoplanetas», añade.
Uno de los descubrimientos más extraños de la ciencia de los exoplanetas hasta ahora es que el tipo de planeta más común en la galaxia son las super-Tierras y los mini-Neptunos, un tipo de planeta que no sabíamos que existía, ya que no se encuentran en nuestro propio sistema solar. En nuestro sistema solar tenemos pequeños planetas rocosos y grandes gigantes de hielo. No sabemos de qué están hechos». Una posibilidad es que estén formados por un núcleo rocoso rodeado por una gran envoltura de hidrógeno y helio. La otra teoría principal es que están hechos principalmente de agua. La medición de su señal de helio podría ayudar a aclarar de qué están hechos los planetas más comunes de la galaxia.
Y luego está la posibilidad de utilizar el helio para identificar Tierras lejanas. Simplemente por su diminuto tamaño, los planetas rocosos como el nuestro son difíciles de distinguir en órbita alrededor de estrellas lejanas. Pero como la emisión de helio emana de la atmósfera superior de los planetas, el planeta parece hasta tres veces más grande en esta longitud de onda que en las longitudes de onda ópticas, dice Spake. La búsqueda de exoplantes en esta longitud de onda debería facilitar la detección de planetas pequeños. El telescopio espacial James Webb, cuyo lanzamiento está previsto para mayo de 2020, debería ser capaz de detectar exoplanetas del tamaño de la Tierra utilizando esta técnica.
«Creemos que el helio es enormemente importante», dice Spake. ‘Esperamos que se utilice mucho más en los próximos años’
James Mitchell Crow es un escritor de ciencia con sede en Melbourne, Australia