 La tabla periódica está organizada como una gran cuadrícula. Cada elemento está colocado en un lugar específico debido a su estructura atómica. Como cualquier cuadrícula, la tabla periódica tiene filas (de izquierda a derecha) y columnas (arriba y abajo). Cada fila y cada columna tienen características específicas. Por ejemplo, el magnesio (Mg) y el calcio (Mg) se encuentran en la columna dos y comparten ciertas similitudes, mientras que el potasio (K) y el calcio (Ca) de la fila cuatro comparten características diferentes. El magnesio y el sodio (Na) también comparten cualidades porque están en el mismo período (configuraciones electrónicas similares).
La tabla periódica está organizada como una gran cuadrícula. Cada elemento está colocado en un lugar específico debido a su estructura atómica. Como cualquier cuadrícula, la tabla periódica tiene filas (de izquierda a derecha) y columnas (arriba y abajo). Cada fila y cada columna tienen características específicas. Por ejemplo, el magnesio (Mg) y el calcio (Mg) se encuentran en la columna dos y comparten ciertas similitudes, mientras que el potasio (K) y el calcio (Ca) de la fila cuatro comparten características diferentes. El magnesio y el sodio (Na) también comparten cualidades porque están en el mismo período (configuraciones electrónicas similares). 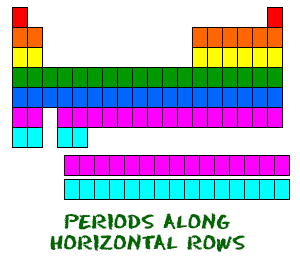 Aunque se saltan algunos cuadros entre ellos, todas las filas se leen de izquierda a derecha. Cuando miras la tabla periódica, cada fila se llama período (¿lo pillas? Como tabla PERIÓDICA.). Todos los elementos de un período tienen el mismo número de orbitales atómicos. Por ejemplo, todos los elementos de la fila superior (el primer período) tienen un orbital para sus electrones. Todos los elementos de la segunda fila (el segundo período) tienen dos orbitales para sus electrones. A medida que se desciende en la tabla, cada fila añade un orbital. En este momento, hay un máximo de siete orbitales de electrones.
Aunque se saltan algunos cuadros entre ellos, todas las filas se leen de izquierda a derecha. Cuando miras la tabla periódica, cada fila se llama período (¿lo pillas? Como tabla PERIÓDICA.). Todos los elementos de un período tienen el mismo número de orbitales atómicos. Por ejemplo, todos los elementos de la fila superior (el primer período) tienen un orbital para sus electrones. Todos los elementos de la segunda fila (el segundo período) tienen dos orbitales para sus electrones. A medida que se desciende en la tabla, cada fila añade un orbital. En este momento, hay un máximo de siete orbitales de electrones.
…y sus grupos
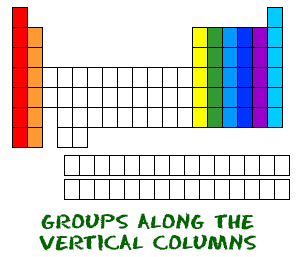 Ahora ya sabes lo de los periodos que van de izquierda a derecha. La tabla periódica también tiene un nombre especial para sus columnas verticales. Cada columna se llama grupo. Los elementos de cada grupo tienen el mismo número de electrones en el orbital externo. Esos electrones exteriores también se llaman electrones de valencia. Son los electrones que participan en los enlaces químicos con otros elementos.
Ahora ya sabes lo de los periodos que van de izquierda a derecha. La tabla periódica también tiene un nombre especial para sus columnas verticales. Cada columna se llama grupo. Los elementos de cada grupo tienen el mismo número de electrones en el orbital externo. Esos electrones exteriores también se llaman electrones de valencia. Son los electrones que participan en los enlaces químicos con otros elementos.
Cada elemento de la primera columna (grupo uno) tiene un electrón en su capa exterior. Cada elemento de la segunda columna (grupo dos) tiene dos electrones en la capa exterior. A medida que vayas contando las columnas, sabrás cuántos electrones hay en la capa exterior. Hay excepciones al orden cuando observas los elementos de transición, pero ya tienes la idea general. Los elementos de transición añaden electrones al penúltimo orbital.
Por ejemplo, el nitrógeno (N) tiene el número atómico siete. El número atómico indica que hay siete electrones en un átomo neutro de nitrógeno. ¿Cuántos electrones hay en su orbital exterior? El nitrógeno se encuentra en la decimoquinta columna, denominada «Grupo VA». La «V» es el número romano de cinco y representa el número de electrones en el orbital exterior. Toda esta información indica que hay dos electrones en el primer orbital y cinco en el segundo (2-5).
El fósforo (P) también está en el grupo VA, lo que significa que también tiene cinco electrones en su orbital externo. Sin embargo, como el número atómico del fósforo es quince, la configuración electrónica es 2-8-5.
Dos en la cima
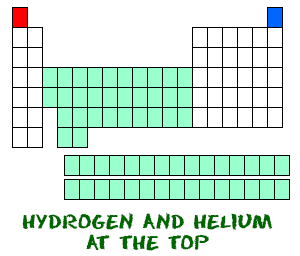 El hidrógeno (H) y el helio (He) son elementos especiales. El hidrógeno, en su forma neutra, no tiene un neutrón. Sólo tiene un electrón y un protón. Es probable que no encuentres hidrógenos atómicos flotando por ahí solos. El hidrógeno atómico quiere combinarse con otros elementos para llenar su capa exterior. Lo más probable es que tu trabajo de química utilice hidrógeno molecular (H2) o iones de hidrógeno (H+, protones).
El hidrógeno (H) y el helio (He) son elementos especiales. El hidrógeno, en su forma neutra, no tiene un neutrón. Sólo tiene un electrón y un protón. Es probable que no encuentres hidrógenos atómicos flotando por ahí solos. El hidrógeno atómico quiere combinarse con otros elementos para llenar su capa exterior. Lo más probable es que tu trabajo de química utilice hidrógeno molecular (H2) o iones de hidrógeno (H+, protones).
El helio (He) es diferente a todos los demás elementos. Es muy estable con sólo dos electrones en su orbital exterior (capa de valencia). A pesar de tener sólo dos electrones, está agrupado con los gases nobles que tienen ocho electrones en sus orbitales más externos. Los gases nobles y el helio están todos «contentos», porque su capa de valencia está llena.
Vídeo relacionado…
Wikipedia: Tabla periódica
Encyclopedia.com: Tabla periódica