INTRODUCCIÓN
Los virus son patógenos especialmente problemáticos en los receptores de trasplantes, ya que la cuestión de las infecciones víricas en los trasplantes refleja un complejo equilibrio entre las diversas infecciones víricas que puede tener un paciente a lo largo de su vida, la respuesta inmunitaria antiviral del receptor y el nivel de inmunosupresión necesario para asegurar un injerto funcional.
La infección por el poliomavirus BK (BKV) es un problema emergente en los trasplantes renales, y se considera el precio que se paga por la moderna y potente inmunosupresión (IS).
Aspectos biológicos del virus
El poliomavirus, junto con el papilomavirus, pertenece a la familia de patógenos del papovavirus. El virus BK (BKV) pertenece a la familia de los poliomavirus junto con otros poliomavirus que se han detectado en el ser humano, como el virus JC (JCV), el virus KI, el virus WU, el virus del carcinoma de células de Merkel y el virus Simian 40 (SV40).
Son virus pequeños, sin envoltura, con un diámetro de 42 nm. La cápside tiene simetría icosaédrica y alberga un genoma de doble cadena circular de ADN con más de 5000 pares de bases, compuesto por una región «temprana» muy conservada que codifica el «antígeno T/t» (TAg), implicado en la transformación, la replicación viral y la regulación y expresión de genes; y una región «tardía» que codifica para las tres proteínas de la cápside, conocidas como VP1, VP2 y VP3, y para una proteína llamada «agnoproteína», una región reguladora no codificante situada entre las otras dos, donde se encuentran los determinantes de la replicación, la unión del TAg y los elementos de regulación transcripcional.
El poliomavirus posee especificidad de adaptación a su hospedador, por lo que su evolución está probablemente asociada a la evolución de la especie hospedadora, por lo que la infección natural se produce sólo en un número limitado de especies estrechamente relacionadas, constituyendo un marcador para establecer las diferencias raciales entre los humanos.
Utilizando el análisis de secuenciación genética, se han establecido diferentes genotipos: Europeo, asiático y africano. El resto de genotipos corresponden a recombinaciones de estos tres, y aunque su origen es difícil de establecer, el estudio de este virus podría proporcionar una herramienta para ayudar a entender la evolución de las migraciones humanas.
El BKV se asocia a dos complicaciones observadas en receptores de trasplantes: La nefropatía asociada al virus BK (BKVN) en los trasplantes de riñón, y la cistitis hemorrágica en los trasplantes de médula ósea. A diferencia del BKV, aunque el JCV reside en el uroepitelio y se reactiva normalmente, rara vez produce nefropatía, pero se asocia con leucoencefalopatía multifocal y encefalitis. El SV40, procedente de los simios, se introdujo en la población humana a través de vacunas contaminadas con polio y adenovirus, y aunque se ha detectado su presencia en biopsias de riñón trasplantado, su importancia en el trasplante renal aún no está bien definida.
EPIDEMIOLOGÍA Y FACTORES DE RIESGO
La infección primaria se produce de forma subclínica durante la primera década de vida, con una seroprevalencia superior al 80% en la población adulta.
La fuente de infección es exclusivamente humana, no se ha demostrado que ningún animal actúe como reservorio, y la vía de transmisión puede ser fecal-oral, respiratoria, transplacentaria y a través de tejidos donados. Durante la fase virémica, el virus infecta los tejidos, el urotelio, el tejido linfático y el cerebro, produciendo una infección lítica latente.
Después de la transmisión viral natural durante la infancia, el BKV permanece en el tracto urinario con reactivaciones intermitentes y bajos niveles de viruria (Vr), del 5% al 10% en adultos inmunocompetentes.1,2 En individuos inmunocomprometidos, la frecuencia de Vr de BK aumenta hasta el 20%-60%, siendo también frecuentes niveles de viruria aún mayores y la aparición de células señuelo en orina.3
En el trasplante renal, la prevalencia de las nefropatías asociadas al virus BK (BKVN) oscila entre el 1% y el 10%,4 basándose más en el tratamiento de inmunosupresión y en los métodos de diagnóstico que por diferencias epidemiológicas reales.
En 2004 se incluyó en la base de datos americana el tratamiento de la infección por BKV tras el trasplante renal como variable de evolución postrasplante (TBKV); posteriormente se analizaron los datos, resultando un total de >48 000 trasplantes, de los cuales 1474 fueron tratados en los 24 meses siguientes. La incidencia acumulada de TBKV aumentó con el tiempo, pasando del 3,45% a los 24 meses al 6,6% a los 60 meses del trasplante.
El fracaso del injerto secundario a la BKVN se produce en una tasa del 50% al 100% a los 24 meses en centros sin programas de cribado, lo que pone de manifiesto la importancia de un diagnóstico precoz de la enfermedad.5
Se han identificado diferentes protocolos de SI como factores de riesgo para el desarrollo de NVCB, especialmente el uso de terapias triples con fármacos anticalcineurínicos, micofenolato mofetilo (MMF) y esteroides,5,6 pero también se han descrito casos de NVCB cuando se utilizan otros regímenes de SI, lo que indica que la intensidad del tratamiento de SI, y no el fármaco específico en sí, es el factor de riesgo en este caso. También existen otros tipos de factores de riesgo, como los factores del paciente (varones >50 años de edad, receptor seronegativo al VKB), los factores del injerto (donante seropositivo al VKB, incompatibilidades HLA, lesión inmunológica o isquémica) y los factores virales (carga viral latente, serotipo de la cápside y capacidad de replicación).7
Diagnóstico histológico y progresión de la BCVN
Las células en decúbito, la viruria y la viremia sólo indican replicación viral, no nefropatía, pero son herramientas clave para prevenir y monitorizar la enfermedad.
El único signo clínico de la BKVN es el deterioro de la función renal, y cuando esto ocurre, ya es demasiado tarde para intervenir, pues el daño renal ya se ha producido.
El diagnóstico de la enfermedad sólo puede realizarse con una biopsia del injerto en la que se encuentren las típicas inclusiones virales nucleares basófilas en las células epiteliales (tubulares, cápsula de Bowman y/o urotelio), y signos de inflamación con tubulitis (Figura 1A), hallazgos similares a los que aparecen en el rechazo agudo del trasplante por células T. Sólo mediante la técnica de inmunohistoquímica para SV-40 LTAg podemos observar una tinción nuclear positiva e identificar al poliomavirus (BK, JC) como responsable de la inflamación, descartando así el diagnóstico de rechazo agudo por células T (Figura 1B) y confirmando el diagnóstico de NVB.
Las lesiones histológicas de la NVB son focales y heterogéneas, por lo que una biopsia negativa no puede excluir el diagnóstico. Como tal, esta prueba debe repetirse si la carga viral en la sangre del paciente permanece persistentemente elevada.
Los patrones histológicos de la NVK2,8,9 se basan en la identificación y extensión del infiltrado inflamatorio y la fibrosis asociada a la infección viral, lo que permite establecer tres patrones histológicos (Figura 2).
EVOLUCIÓN CLÍNICA Y OPORTUNIDADES DE PREVENCIÓN Y DIAGNÓSTICO PRECOZ
La evolución clínica común de la BKVN9 se representa en la Figura 3, que muestra cómo el desarrollo de la enfermedad se predice por la aparición de la viruria BK (BK Vr), una consecuencia de la reactivación y replicación viral en el tracto urinario, con la aparición de las típicas células señuelo (figura 4), que son fáciles de identificar mediante las pruebas rutinarias de citología de orina. Sin embargo, la cuantificación de Vr mediante técnicas de PCR es más sensible que el uso de la citología, y permite distinguir entre las infecciones por BKV y JCV.
Cuando la viruria es de >105 copias/ml y persiste, es seguida semanas o meses después por el desarrollo de viremia (Vm) a >107 copias/ml y, finalmente, BKVN. La BK Vr no es diagnóstica de daño parenquimatoso renal, pero la aparición simultánea de Vm y Vr es patognomónica de daño parenquimatoso renal (BKVN). La Vm mantenida, o más típicamente creciente, es un factor predictivo de deterioro de la función renal, y se correlaciona con la presencia y gravedad de las lesiones histológicas. En pacientes con una función renal normal o moderadamente baja, la probabilidad de encontrar indicadores histológicos de NVCB es directamente proporcional a la duración y la gravedad de la viremia. Una viremia elevada y sostenida identifica a aquellos pacientes con una replicación viral incontrolada que conduce al daño renal.
En conclusión, el diagnóstico y la intervención tempranos minimizan el daño del trasplante. La figura 5 muestra un algoritmo de diagnóstico basado en publicaciones anteriores.4,9
Tratamiento de la BKVN
El mejor tratamiento de la BKVN es un diagnóstico precoz de la enfermedad para actuar antes de que se produzca el daño renal.
Por este motivo, las Guías KDIGO10 sugieren utilizar un proceso de cribado para todos los pacientes trasplantados renales mediante la realización de pruebas mensuales de los niveles de Vm durante los primeros 3 meses (2D) y cada tres meses hasta el final del primer año (2D), siempre que se produzca una disfunción renal sin causa alternativa visible (2D), y tras el tratamiento de un episodio de rechazo agudo (2D). También se sugiere una reducción de la IS cuando la Vm es persistentemente superior a 107 copias/ml (2D).
Respecto a la reducción de la IS, el primer paso consiste en aplicar el protocolo estándar (no dar CAN ni tratamientos antiproliferativos por encima de los niveles indicados para el rango terapéutico), seguido de la medición de la viremia cada 4 semanas, la reducción de la NAb en un 15%-20%, la reducción del MMF y/o la supresión del MMF en un 50%, y/o la sustitución del TAC por CsA o un ISP (Figura 6).11
En cuanto a los tratamientos antivirales, se han utilizado empíricamente inmunoglobulinas i.v., ciclofovir, leflunomida y quinolonas, cuya eficacia es difícil de determinar en la actualidad por no haber sido administrados en combinación con una reducción de la IS y por la falta de estudios prospectivos controlados y aleatorizados.
Por último, nos gustaría comentar el retrasplante renal en pacientes que han perdido un injerto por BKVN. La recurrencia de la enfermedad en estudios cortos es del 12%. Las recomendaciones que se deben tener en cuenta en estas situaciones son: 1) informar al paciente sobre el mayor riesgo potencial de recurrencia de la NVCB; 2) confirmar la ausencia de replicación viral (PCR en sangre y orina cuando el paciente es incluido en la lista de trasplante y cada 6 meses después), el paciente debe recibir el trasplante con resultados negativos de PCR en muestras de sangre, y 3) adaptar el SI a la patología.12-14
PUNTOS CLAVE
1. Las potentes y modernas formas de inmunosupresión podrían ser responsables del aumento de la prevalencia de esta infección
2. La infección por el virus BK en pacientes inmunocomprometidos podría afectar a la función y la supervivencia de los trasplantes renales
3. El diagnóstico precoz mediante la monitorización estricta del recuento de células señuelo en orina y/o de la viruria y la viremia es crucial para evitar las repercusiones negativas de esta complicación
4. No existe evidencia de un tratamiento específico eficaz para esta infección. Sólo una reducción del tratamiento inmunosupresor puede minimizar la virulencia.
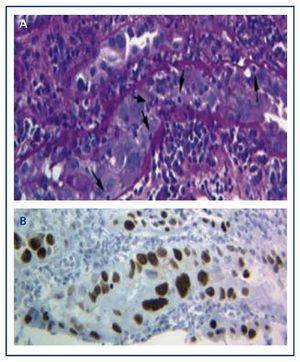
Figura 1. Inclusiones virales nucleares basófilas en las células epiteliales y tubulitis en la nefropatía por el virus BK (a) e inmunohistoquímica para el antígeno SV-40 LTAg (b)

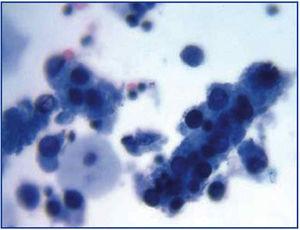
Figura 3. Células señuelo dispersas y cilindros celulares que contienen células señuelo compactadas. Cuando aparecen, estos cilindros son patognomónicos de daño renal
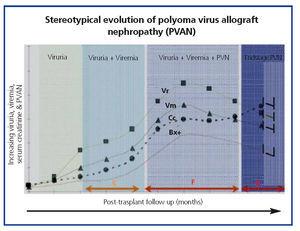
Figura 4. Fases de la evolución de la nefropatía asociada al virus BK
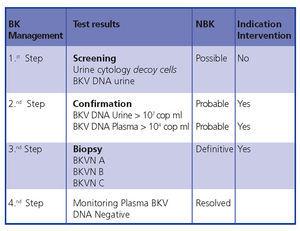
Figura 5. Algoritmo de diagnóstico de la BKVN

Figura 6. Algoritmo de tratamiento de la BKVN