

Niels Bohr transformó por completo nuestra visión del átomo y del mundo. Al darse cuenta de que la física clásica falla catastróficamente cuando las cosas tienen el tamaño de un átomo o son más pequeñas, remodeló el átomo para que los electrones ocuparan órbitas «permitidas» alrededor del núcleo mientras que todas las demás órbitas estaban prohibidas. Al hacerlo, fundó la mecánica cuántica.
Más tarde, como uno de los principales arquitectos de la interpretación de Copenhague de la mecánica cuántica, ayudó a remodelar nuestra comprensión de cómo funciona la naturaleza a escala atómica.
Inicios
Niels Henrik David Bohr nació el 7 de octubre de 1885 en la capital de Dinamarca, Copenhague. Era el segundo de tres hijos de una familia próspera de clase alta.
Su padre era Christian Bohr, un brillante profesor de fisiología que más tarde sería nominado dos veces al Premio Nobel. Su madre era Ellen Adler, hija de un rico político danés.
Su padre se había criado en una familia luterana y su madre en una familia judía. Niels fue bautizado como luterano a los seis años para complacer a una de sus abuelas. Ni su padre ni su madre practicaban sus religiones.
Los padres de Niels estaban profundamente apasionados por la educación de sus hijos. Niels recibió clases en casa hasta que comenzó la escolarización formal a los 7 años en la Escuela de Gramática de Gammelholm. La escuela era tanto primaria como secundaria. Tenía una disciplina estricta y esperaba que sus alumnos trabajaran duro.
Su padre traía a casa a diversos compañeros profesores de la Universidad de Copenhague y los niños Bohr podían escuchar las conversaciones, que eran muy variadas y en las que se hablaba de ciencia, filosofía y artes.
Fuerza física e intelectual
Niels era bueno en la mayoría de las asignaturas escolares, pero era bastante flojo en su lengua materna, el danés. Aunque le encantaba hablar, le disgustaba profundamente escribir redacciones. Con un talento natural para las matemáticas, se sintió cada vez más atraído por las ciencias.
La física interesaba especialmente a Niels y, cuando era adolescente, ya corregía los errores de los libros de texto de su escuela. Además de su vigor intelectual, también era inusualmente fuerte físicamente. No sólo corregía los libros de texto; también «corregía» a otros estudiantes, metiéndose en peleas en la escuela, que normalmente ganaba.
Aunque con el tiempo se convertiría en uno de los mayores físicos teóricos del mundo, tenía talento prácticamente con las manos. Él y su hermano menor pasaban horas haciendo cosas en el taller de su padre.
Su padre vio que Niels tenía potencial para convertirse en un científico destacado. Sin embargo, ninguno de los padres de Niels quería que su hijo creciera con intereses estrechos. Se aseguraron de que recibiera una buena formación cultural y deportiva.
Su padre era especialmente entusiasta de las obras del autor alemán Goethe y recitaba regularmente grandes fragmentos de Fausto a sus hijos. A su padre también le gustaba el fútbol y animaba a sus hijos a jugar en la escuela y la universidad. Niels se convirtió en portero, mientras que su hermano menor, Harald, llegó a jugar con Dinamarca y ganó una medalla de plata olímpica.

Izquierda: Christian Bohr. Derecha: (de izquierda a derecha): Madre e hijos. Los tres hijos de Bohr se graduaron en la Universidad de Copenhague. Jenny se convirtió en profesora de historia y danés. Harald se convirtió en un ilustre matemático.
Título de Bachiller y algunos trabajos de investigación notables
En 1903, con 17 años, Niels se graduó en el instituto. Ese mismo año comenzó sus estudios en la Universidad de Copenhague. Estudió astronomía, química y matemáticas, y se especializó en física.
En febrero de 1905, mientras trabajaba para obtener su título, la Real Academia Danesa de Ciencias anunció que se concedería una medalla de oro al mejor trabajo de investigación sobre los métodos para medir la tensión superficial de los líquidos. Se trataba de un premio destinado a científicos experimentados, no a estudiantes universitarios. Niels era consciente de su propia fuerza creciente en física y era ambicioso; decidió que se presentaría al concurso.
Tuvo la suerte de tener un profesor por padre. Su padre le dejó espacio en su laboratorio de fisiología para hacer experimentos. Durante meses, Niels trabajó solo y obsesivamente durante la noche, fabricando su propio equipo y utilizándolo para formar chorros de agua y realizar mediciones.
Su padre, al reconocer la creciente obsesión de su hijo por los experimentos, le ordenó que dejara de hacerlo y que escribiera sus investigaciones. Niels se retiró a la rica finca de sus abuelos maternos para hacerlo. El trabajo que presentó a finales de octubre de 1906 era lo suficientemente brillante como para ganar una medalla de oro, un logro notable para un estudiante. Compartió el premio con Peder Pedersen, 11 años mayor que él, que pronto se convertiría en profesor de ingeniería eléctrica.
Niels Bohr se licenció en 1907.
M.S. y Doctorado.
En los años 1907 – 1911, Bohr completó su M.S. y su Doctorado en física. En ambos casos se centró en la teoría de los electrones de los metales. Su doctorado, concedido en abril de 1911, fue un trabajo puramente teórico.
La física explota
Bohr se introdujo en la física en un momento especialmente emocionante.
- En 1897, cuando Bohr tenía 12 años, J. J. Thomson descubrió el electrón.
- En 1898, Ernest Rutherford descubrió las partículas alfa y beta emitidas por el uranio.
- En 1905, cuando Bohr comenzaba su investigación para ganar la medalla de oro, Albert Einstein desató un aluvión de nuevas ideas en su año milagroso, escribiendo cuatro artículos que cambiaron el mundo sobre: El movimiento browniano, la equivalencia de masa y energía, el efecto fotoeléctrico y la relatividad especial.
- En 1909, Ernest Rutherford descubrió el núcleo atómico.
Un mal comienzo con J. J. Thomson
Bohr recibió financiación para realizar un año de trabajo postdoctoral en el extranjero y tuvo la suerte de ser uno de los pocos elegidos aceptados para trabajar en el Laboratorio Cavendish de J. J. Thomson en la Universidad de Cambridge, en Inglaterra. Llegó en octubre de 1911.
Bohr, que entonces tenía 26 años, tuvo un mal comienzo con Thomson. Con una escandalosa falta de sutileza, lo primero que el joven físico le dijo al gran hombre fue «esto está mal» y le señaló una página de un libro escrito por Thomson. Quizás este desafortunado primer encuentro tuvo algo que ver, pero a Bohr le costó hacerse con el trabajo del Laboratorio Cavendish. La investigación no le atraía.
Ernest Rutherford – Las cosas mejoran
A finales de 1911, Bohr había conocido a otro gran físico, Ernest Rutherford, cuyo laboratorio estaba en la Universidad de Manchester. Le preguntó a Rutherford si podía trasladarse allí para trabajar con él. Rutherford dijo que sí, siempre que Bohr obtuviera primero la aprobación de Thomson.
Y así, en marzo de 1912, Bohr cogió el tren a Manchester para trabajar con el hombre que le inspiraría y se convertiría en uno de sus mejores amigos.
Rutherford había ganado el Premio Nobel de Química de 1908 por sus trabajos sobre la radiactividad. En 1909 había descubierto el núcleo atómico. Sin embargo, a pesar de la gran reputación de Rutherford, su afirmación de que el átomo estaba formado por un núcleo diminuto, muy denso y con carga positiva, rodeado de electrones con carga negativa, había tenido una respuesta tibia por parte de otros físicos.
Bohr se interesó cada vez más por el modelo del átomo de Rutherford, en particular por el comportamiento de sus electrones, el tema de su tesis doctoral.
Él y Rutherford se convirtieron en los mejores amigos y, en los años siguientes, ellos y sus esposas pasarían felices vacaciones juntos. 25 años después de haber trabajado juntos por primera vez, Bohr estaría junto a la familia de Rutherford en el funeral del gran hombre.
Grandes ideas
Bohr regresó a Dinamarca en el otoño de 1912 con dos ideas principales:
En primer lugar, quería comprender el comportamiento de los electrones en el átomo.
En segundo lugar, resolvió modelar su propio comportamiento como físico sobre el de Rutherford. Bohr encontró inspiradores la energía, el entusiasmo y los conocimientos ilimitados de Rutherford. También le resultaba muy agradable el ambiente intelectualmente estimulante del grupo de Rutherford. Esperaba poder crear algún día un grupo de investigación igual de extraordinario en Copenhague.
Contribuciones de Niels Bohr a la ciencia
Bohr consiguió trabajo como profesor a su regreso a la Universidad de Copenhague.
Mientras tanto, su investigación en física teórica se centró en comprender el lugar del electrón en el átomo.
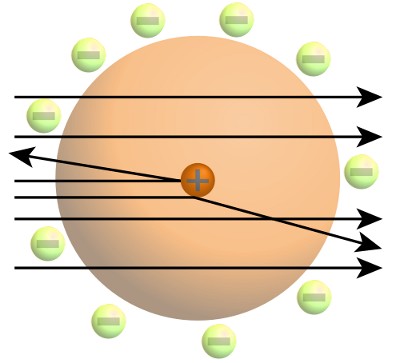
El trabajo de Rutherford había revelado que los átomos estaban formados por un pequeño y denso núcleo con carga positiva. La mayor parte del volumen de un átomo era un espacio vacío patrullado de alguna manera por electrones cargados negativamente.
Ahora buscó en la nueva física cuántica de Max Planck y Albert Einstein una solución al comportamiento aparentemente imposible de los electrones. De hecho, se inició en esta vía en Manchester en 1912.
La física cuántica había establecido que cuando un objeto irradia ondas de calor o luz, la emisión no se produce en un flujo continuo, sino en paquetes distintos de energía de onda.
Einstein llamó a estos paquetes distintos fotones. Como todas las ondas, los fotones tienen una velocidad, una frecuencia y una longitud de onda.
Planck dedujo que la cantidad de energía transportada por un fotón podía encontrarse multiplicando sólo dos números. Estos eran la frecuencia de la luz y un número que ahora llamamos la constante de Planck. Su ecuación decía E = hf, donde E es la energía, h es la constante de Planck y f es la frecuencia.
Es evidente que un fotón sólo podía transportar una cantidad de energía que fuera múltiplo de un número: la constante de Planck. Todas las demás energías estaban prohibidas. Esta era la esencia de la teoría cuántica: a la luz se le permitía tener ciertas cantidades de energía, pero se le prohibía tener otras.
Por mucho que Bohr trabajara, por mucha literatura que leyera y por mucho que discutiera el problema con sus colegas, no pudo encontrar una forma de llevar la teoría cuántica -en otras palabras, los estados permitidos y los estados prohibidos- al comportamiento del electrón en el átomo.
Entonces, en febrero de 1913, llegó el gran avance. Oyó hablar de la serie de Balmer y de la fórmula de Balmer.

Parte de la serie de Balmer. Estos colores de luz son emitidos por el hidrógeno a altas temperaturas. La longitud de onda y la frecuencia de los diferentes colores de la luz pueden ajustarse a una fórmula: la Fórmula de Balmer.
En 1885, el matemático suizo Johann Balmer dio con una fórmula matemática que predecía las longitudes de onda -y por tanto los colores- de la luz emitida por el hidrógeno caliente. La fórmula no tenía ninguna base teórica. Simplemente funcionaba!
Ahora Bohr sentía que realmente tenía algo. Tomó la fórmula de Balmer y utilizó la nueva teoría cuántica para demostrar por qué funcionaba. Al hacerlo, se convirtió en el padre de la mecánica cuántica, la física de los objetos a escala atómica.
Bohr propuso que la relación E = hf era la base para explicar el comportamiento de los electrones. Al igual que la energía de la luz venía en distintos paquetes de energía, lo mismo ocurría con los electrones. Sólo se permitían ciertos valores de energía de los electrones, y podían calcularse para el hidrógeno utilizando la fórmula de Balmer.
En la fórmula de Balmer, Bohr sustituyó la fórmula de Planck y algunos otros números importantes, incluyendo la masa del electrón, y su carga.
El resultado matemático, en términos sencillos, fue un átomo que puede imaginarse como un diminuto sistema solar. Al igual que los planetas orbitan alrededor del sol, los electrones orbitan alrededor del núcleo atómico en órbitas fijas. Cuanto más lejos esté un electrón del núcleo, mayor será su energía. A diferencia de los planetas, más de un electrón puede compartir una órbita alrededor del núcleo.
Bohr arroja nueva luz sobre un viejo problema
Los científicos se habían preguntado durante mucho tiempo cómo podía la materia absorber y emitir luz. El nuevo modelo del átomo de Bohr ofreció la explicación.
Bohr dijo que los electrones están restringidos a órbitas circulares particulares, pero pueden saltar de una órbita de menor energía a otra de mayor energía absorbiendo luz. También pueden hacer lo contrario y caer de una órbita de mayor energía a otra de menor energía emitiendo luz – como se muestra en la imagen de abajo.
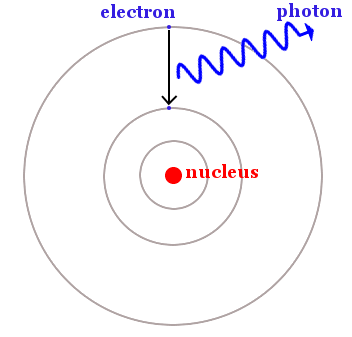
Un electrón cae de una órbita de mayor energía a otra de menor energía. La energía se libera como un fotón de luz. La diferencia de energía entre las órbitas es la misma que la energía del fotón, que se puede calcular mediante la ecuación de Planck, E = hf.
En la física clásica, los electrones podían tener cualquier energía. En la nueva física cuántica los electrones estaban confinados en órbitas definidas de energía fija. Otras energías de los electrones estaban prohibidas.
Cuando un electrón absorbía energía realizaba un salto cuántico, desapareciendo de una órbita y apareciendo en otra superior a través de una zona de energía prohibida. Cuando un electrón perdía energía desaparecía de una órbita de mayor energía y aparecía en una órbita de menor energía separada por una zona prohibida.
La teoría cuántica «explicaba» por qué los electrones no irradian su energía al caer en el núcleo, porque este proceso está prohibido: el núcleo no es una órbita de energía permitida para un electrón.
La teoría cuántica también explicó los espectros de los átomos, mostrando que los colores intensos en los espectros estaban relacionados con las energías de las órbitas de los electrones en los átomos.

El espectro de emisión del helio. Las intensas líneas revelan las energías de los orbitales de electrones permitidos en el helio.
La fundación de la química cuántica
Bohr demostró que las propiedades químicas de los elementos son el resultado principalmente del comportamiento de los electrones que ocupan el orbital estable más alto, los llamados electrones de valencia. Al hacerlo, explicó gran parte de la estructura de la tabla periódica y fundó una nueva disciplina científica: la química cuántica.
Bohr hace avanzar nuestra comprensión del átomo mediante un salto cuántico
En 1912, muchos científicos ni siquiera habían asumido el modelo de Rutherford. En 1913, Bohr combinó las matemáticas con su poderosa intuición física para establecer que los electrones orbitan alrededor del núcleo en trayectorias definidas. El modelo del átomo de Rutherford-Bohr se sigue enseñando en los institutos.
Bohr abrió el átomo a la teoría cuántica: era un objeto que cambiaba de estado por pasos en lugar de hacerlo suavemente.
Sin embargo, su teoría sólo funcionaba bien para átomos con un electrón, es decir, hidrógeno o helio ionizado. No obstante, el paso de Bohr fue crucial: abrió la puerta. Pronto, el mundo cuántico se llenó de físicos diligentes que exploraban con avidez sus extraños rincones.
 «Todo el campo de trabajo ha pasado de un estado muy solitario a uno desesperadamente abarrotado en el que casi todo el mundo parece trabajar con ahínco.»
«Todo el campo de trabajo ha pasado de un estado muy solitario a uno desesperadamente abarrotado en el que casi todo el mundo parece trabajar con ahínco.»
En la década de 1920, Werner Heisenberg y Erwin Schrödinger proporcionaron una visión cuántica muy mejorada del lugar del electrón en el átomo.
Bohr en demanda
Bohr publicó tres famosos artículos cuánticos en 1913. Al hacerlo, su reputación como físico disfrutó de su propio salto cuántico. Impartió seminarios en la Universidad de Gotinga (Alemania) -el centro del universo matemático- y aceptó una oferta de Ernest Rutherford para volver a Manchester en un puesto de investigación académica de alto nivel.
El estallido de la Primera Guerra Mundial complicó las cosas, pero Bohr trabajó de 1914 a 1916 en Manchester.
Después regresó a Copenhague para ocupar la primera cátedra de física teórica de la universidad. Consiguió dinero para establecer un instituto de investigación de física teórica como parte de la universidad, siguiendo el modelo del grupo de investigación de Rutherford. Werner Heisenberg y varios otros arquitectos de la nueva mecánica cuántica desarrollaron sus ideas en Copenhague bajo la dirección de Bohr.
Hoy en día el Instituto Niels Bohr sigue funcionando en la vanguardia de las ciencias físicas.
Premio Nobel
Bohr fue galardonado con el Premio Nobel de Física de 1922 por el trabajo realizado en 1913.
La interpretación de Copenhague de la mecánica cuántica
A medida que se desarrollaba la mecánica cuántica, surgían diferentes puntos de vista sobre cómo debía interpretarse. Hubo una gran disputa intelectual (siempre de buen grado y no agria) entre Einstein y Bohr sobre si, parafraseando a Einstein, Dios juega a los dados con el universo. Einstein dijo que no, Bohr dijo que sí.

Bohr y Einstein disfrutaban de la compañía del otro y estaban de acuerdo en muchas cosas, pero no podían ponerse de acuerdo sobre el mundo cuántico.
Hoy en día la gran mayoría de los físicos aceptan la propuesta de Bohr de que Dios sí juega a los dados con el universo.
En la escala atómica el mundo puede parecer extravagante para cualquiera que espere interpretarlo según las leyes del «sentido común» o incluso las reglas de la física clásica. Es un mundo en el que algo que normalmente consideramos como una onda, como la luz por ejemplo, puede comportarse como una partícula. O algo que normalmente consideramos una partícula, como un electrón, puede comportarse como una onda. Un solo neutrón puede parecer que está en dos lugares simultáneamente, a unos pocos centímetros de distancia. Es un mundo en el que se puede pensar que un gato está vivo y muerto (o en algún estado intermedio) al mismo tiempo.
Tres de los gigantes de la física del siglo XX -Niels Bohr, Werner Heisenberg y Wolfgang Pauli- fueron los protagonistas del desarrollo de lo que llegó a conocerse como la interpretación de Copenhague de la mecánica cuántica. Pauli tuvo que mediar entre Bohr y Heisenberg (que trabajaba en el instituto de Bohr) porque a veces discrepaban tan ferozmente sobre cómo debía interpretarse el mundo cuántico que apenas podían hablarse.
De este abrasador crisol intelectual surgieron cuatro de las ideas más importantes de lo que llegó a conocerse como la interpretación de Copenhague de la teoría cuántica. Estas fueron:
- Principio de complementariedad de Bohr/Principio de incertidumbre de Heisenberg
- Dualidad onda-partícula
- Interpretación de las funciones de onda-funciones de onda mediante probabilidades
- El principio de correspondencia -la fusión de la mecánica cuántica en la mecánica clásica a números cuánticos mayores
Cualquiera que sean las implicaciones filosóficas de la interpretación de Copenhague -y hay muchas-, por ejemplo que la realidad no existe a menos que la busques, lo que sabemos con certeza es que los métodos de la mecánica cuántica funcionan en la práctica.
La mecánica cuántica es la herramienta más poderosa que hemos tenido nunca para averiguar cómo funciona el universo a escala atómica.
El núcleo compuesto
Con el descubrimiento del neutrón por James Chadwick en el laboratorio de Rutherford en 1932, Bohr dirigió su atención al núcleo atómico.
Las reacciones nucleares le fascinaban, en particular las reacciones en las que los núcleos atómicos eran bombardeados con neutrones para formar nuevos núcleos radiactivos, las reacciones de captura de neutrones.
Insatisfecho con los intentos de otros físicos de explicar la captura de neutrones, Bohr formuló la teoría del núcleo compuesto en 1934 y 1935, publicándola en 1936. Su idea era que cuando un neutrón entra en un núcleo, choca repetidamente con un gran número de neutrones y protones existentes, no sólo con uno de ellos. El resultado es un núcleo compuesto semiestable. Este núcleo se encuentra en un estado de alta energía como resultado de las colisiones y pierde esta energía de diferentes maneras, como perdiendo un neutrón o emitiendo rayos gamma.
La teoría de Bohr ocupó el centro de la escena durante las dos décadas siguientes, hasta que en la década de 1950 su hijo Aage desempeñó un papel clave en la formulación de un modelo mejorado del núcleo y las reacciones nucleares.
El núcleo como una gota de líquido
En 1939 Niels Bohr y John Archibald Wheeler cooperaron para producir el modelo de gota de líquido. Este modelo representaba el núcleo como una gota giratoria de líquido incompresible que se mantiene unida por la tensión superficial.
Una gota de líquido puede deformarse a partir de su forma esférica básica y una gran gota de líquido puede deshacerse en dos nuevas gotas. Del mismo modo, un gran núcleo atómico, como el uranio, podría separarse para formar dos nuevos núcleos atómicos: esto es la fisión nuclear, la fuente de energía que está detrás de la bomba atómica de uranio y de la central eléctrica de uranio.

El diminuto núcleo atómico se modeló como una gota de líquido que se mantiene unida por la tensión superficial. Al igual que un líquido, la forma de la gota era esférica, pero podía deformarse a partir de esta forma.
El modelo de la gota líquida tuvo sus mayores éxitos al explicar las propiedades de los núcleos pesados, como el uranio.
El Proyecto Manhattan
En abril de 1940, Dinamarca fue invadida por las fuerzas armadas de la Alemania nazi. La madre de Bohr era judía, por lo que podía tener problemas. Al principio, por suerte, no los hubo.
En septiembre de 1943, los nazis decidieron deportar a los judíos de Dinamarca a campos de concentración. Bohr recibió un chivatazo de que los nazis pretendían detenerlo. La familia Bohr huyó en barcos de pesca a través del corto tramo de agua que separa Dinamarca de Suecia. Suecia era oficialmente neutral y no había sido invadida por los nazis. Casi todos los 7.000 judíos de Dinamarca huyeron por mar a Suecia en 1943.
En octubre de 1943, con una semana de diferencia, Niels y su hijo Aage volaron desde Suecia sobre la Noruega ocupada por los nazis hasta el Reino Unido. Volaron en las bahías de bombas de los aviones de guerra británicos que llegaron a Suecia para recogerlos. Margrethe Bohr permaneció en Suecia hasta el final de la guerra.

A la edad de 58 años, Niels Bohr voló desde Suecia a gran altura sobre la Noruega ocupada por los nazis y el Mar del Norte hasta Escocia en un Mosquito de Havilland. Durante el vuelo, se acostó en el lugar donde normalmente se colocan las bombas del avión. El suministro de oxígeno falló durante el vuelo y perdió el conocimiento. El piloto, tras perder la comunicación con Bohr, adivinó lo que había sucedido y bajó el avión a una altura inferior. Bohr recuperó el conocimiento cuando aterrizaron.
Una vez a salvo en el Reino Unido, padre e hijo comenzaron a investigar científicamente para el Gobierno británico, trabajando en el proyecto de la bomba atómica dirigido por James Chadwick.
En 1944, padre e hijo se involucraron en el Proyecto Manhattan, pasando mucho tiempo tanto en Estados Unidos como en Londres. Para mantener en secreto su presencia en América, viajaron bajo los nombres de «Nicholas Baker» y «James Baker».
Algunos detalles personales y el final
En 1912, Bohr se casó con Margrethe Nørlund en Copenhague. Tuvieron seis hijos, uno de los cuales, Aage Bohr emularía a su padre ganando un Premio Nobel de Física.
Niels Bohr murió a los 77 años de edad de un repentino fallo cardíaco en su casa de Copenhague el 18 de noviembre de 1962. Sus cenizas fueron enterradas en el cementerio Assistens de Copenhague, cerca de las tumbas de sus padres y de su hermano Harald. Las cenizas de Margrethe también fueron enterradas allí cuando murió.
Autor de esta página: The Doc
Imágenes mejoradas digitalmente y coloreadas por esta web. © Todos los derechos reservados.
Cite esta página
Por favor, utilice la siguiente cita conforme a MLA:
"Niels Bohr." Famous Scientists. famousscientists.org. 19 Dec. 2015. Web. <www.famousscientists.org/niels-bohr/>.
Publicado por FamousScientists.org
Lectura adicional
A. P. French, P. J. Kennedy
Niels Bohr: A Centenary Volume
Harvard University Press, 1987
Abraham Pais
Los tiempos de Biels Bohr: In Physics, Philosophy, and Polity
Clarendon Press, 1993
Ray Spangenburg, Diane Kit Moser
Niels Bohr, Revised Edition
Infobase Publishing, 1 Jan 2009
Richard Rhodes
The Making of the Atomic Bomb
Simon and Schuster, 2012
J.R. Nielsen
Niels Bohr Collected Works: Volume 1 Early Work (1905 – 1911)
Elsevier, 2013