¿Qué es el reflujo?
Muchas reacciones químicas orgánicas tardan mucho en completarse, y para acelerar estas reacciones se aplica calor. Los compuestos orgánicos suelen ser volátiles, con altas presiones de vapor y bajos puntos de ebullición. Cuando se calientan hasta cierto punto, se vuelven inflamables y provocan explosiones. Por lo tanto, la aplicación de calor debe hacerse de forma específica para superar el problema de evaporar demasiado disolvente y secar el recipiente de reacción.
El reflujo consiste en calentar la reacción química durante un tiempo determinado, mientras se enfría continuamente el vapor producido hasta su forma líquida, utilizando un condensador. Los vapores producidos por encima de la reacción sufren continuamente una condensación, volviendo al matraz en forma de condensado. De este modo, se garantiza que la temperatura de la reacción permanezca constante.
Los reactantes para los experimentos de reflujo pueden ser sólidos y líquidos, o ambos líquidos. La temperatura a la que se calienta la reacción depende de los puntos de ebullición de los disolventes y también del anillo de reflujo (véase más adelante).
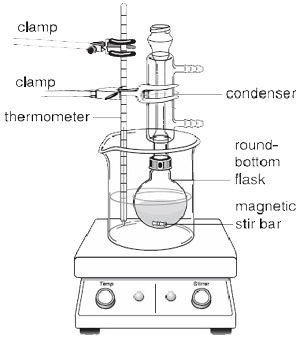
Si los reactivos añadidos al matraz de fondo redondo no son demasiado viscosos, se puede emplear una barra de agitación magnética para evitar el choque violento del líquido en ebullición y garantizar un calentamiento uniforme. Como se muestra en la figura 2, cuando se utiliza una barra de agitación magnética debe usarse una placa caliente en lugar de un manto calefactor, ya que contiene un agitador magnético que permite hacer girar la barra automáticamente mientras se produce el reflujo
El condensador se llena siempre completamente de agua para asegurar un enfriamiento eficaz. Los vapores, que se desprenden de la mezcla líquida de reacción, cambian de fase gaseosa a fase líquida debido a la pérdida de calor. Esto hace que la mezcla líquida vuelva a caer en el matraz de fondo redondo.
Durante la reacción, una parte del disolvente sube por el tubo del condensador antes de condensarse de nuevo en el matraz. Por encima de este punto, la camisa interior del condensador aparecerá seca. Por debajo de este punto, el disolvente vuelve a fluir hacia el matraz. El límite entre estas dos partes es el anillo de reflujo. La temperatura de la reacción debe establecerse de forma que el anillo de reflujo esté sólo entre un tercio y la mitad del condensador.
Para saber que se ha alcanzado el punto de ebullición, se producen burbujas de vapor dentro del líquido. Si se aumenta la velocidad de calentamiento, la temperatura de los reactivos no varía, pero aumenta la velocidad con la que el líquido en ebullición se transforma en vapor. Este aumento se debe al mayor suministro de energía que facilita que más moléculas de líquido superen sus interacciones intermoleculares para entrar en la fase gaseosa.
Cuando se calienta una mezcla de dos o más compuestos volátiles, la presión de vapor total (PT) de la mezcla es igual a la suma de las presiones de vapor del compuesto 1 y 2 (P1 y P2) en la mezcla. La magnitud de la presión de vapor ejercida por cada compuesto está determinada por la presión de vapor de ese compuesto (P0) y las fracciones molares de ambos compuestos 1 y 2 presentes en la mezcla (X1 y X2).
Para una solución ideal de dos compuestos, la presión de vapor de la solución se expresa mediante la Ley de Raoult, que se muestra en la siguiente ecuación:
PT = X1P10 + X2P20
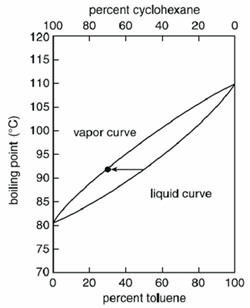
Dependiendo de la mezcla, la temperatura hierve de forma variable. Las mezclas homogéneas hierven a una temperatura comprendida entre los puntos de ebullición de los compuestos puros, pero el valor exacto depende de la cantidad (masa o volumen) de cada compuesto.
Por ejemplo, una mezcla líquida al hervir producirá un vapor que contendrá un mayor porcentaje del compuesto más volátil. En una mezcla de ciclohexano y tolueno, el ciclohexano es más volátil entre los dos y un líquido compuesto por un 50 por ciento de ciclohexano y un 50 por ciento de tolueno herviría a 90°C y produciría un vapor compuesto por un 70 por ciento de ciclohexano y un 30 por ciento de tolueno.
Cuando se trata de separar compuestos, un método común que se utiliza en química orgánica es la destilación, que separa los compuestos basándose en las diferencias en los puntos de ebullición.
En experimentos más sofisticados, el reflujo y la destilación pueden llevarse a cabo al mismo tiempo. Por ejemplo, mientras una reacción está en reflujo, se puede llevar a cabo una destilación a microescala utilizando un equipo especializado. La destilación a microescala consiste en acortar el recorrido de la destilación para reducir la posibilidad de pérdida de material en el proceso.
 |
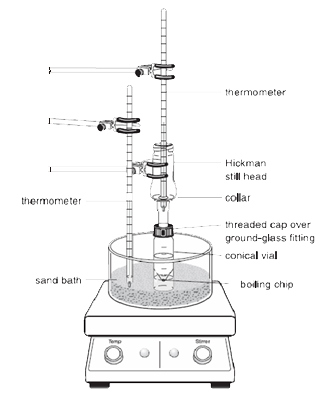 |
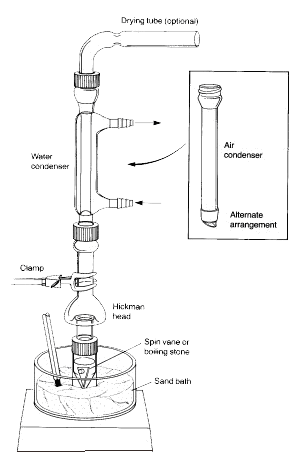
Nota: Los vapores del líquido calentado ascienden y se enfrían para condensarse en las paredes interiores del cabezal Hickman o en las paredes del condensador.
El líquido que escurre hacia abajo se acumula en el pozo circular del fondo del alambique.
1.La ampolla cónica debe ser fijada de forma segura al cabezal de destilación Hickman y al condensador de aire utilizando el tapón de compresión y la abrazadera metálica. Todas las piezas deben tener una unión esmerilada y encajar bien de forma que no se produzcan fugas importantes.
2.La veleta debe ser colocada en el vial cónico y estar apuntando hacia abajo. El tabique plano y el pequeño tapón de compresión se utilizan para cerrar el puerto lateral del cabezal Hickman. Todo el montaje se coloca en el orificio correspondiente del Al-block o del baño de arena y se centra en la placa caliente antes de comenzar a agitar (de lo contrario, la veleta giratoria se volcará y girará de forma inadecuada).
3.El cabezal Hickman y el condensador de aire deben ser enfriados con una toalla de papel húmeda. La fuente de calor debe ajustarse para que el compuesto de interés se destile lentamente.
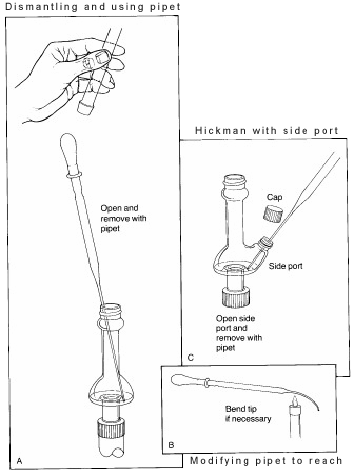
En la configuración anterior, el cabezal de destilación Hickman actúa como condensador de aire y como recipiente de recogida de condensado para destilaciones simples o fraccionadas. El cabezal Hickman puede separarse en dos tipos: con puerto y sin puerto.
Es más fácil recoger las fracciones con el cabezal Hickman con puerto. Para ello se debe abrir el puerto para extraer el líquido del pozo con una pipeta Pasteur (véase ‘C’ en la Figura 3).
Para el cabezal Hickman sin puerto, se utiliza la pipeta Pasteur para extraer el líquido de la parte superior. (ver ‘A’).
Si se utiliza un condensador o un termómetro interno, el aparato de destilación debe ser parcialmente desmontado para poder hacerlo. En algunos alambiques, el diámetro interno del cabezal es tan pequeño que es difícil alcanzar en ángulo con la pipeta y hacer contacto con el líquido. Para solucionar este problema, la punta de la pipeta debe doblarse ligeramente en una llama.
Una vez extraído, el líquido se transfiere a un pequeño vial y se tapa con un tapón con sello de teflón.Si hay más de un compuesto volátil en el vial, será necesario empezar con poco calor para destilar primero el compuesto de menor ebullición. De esta manera, los compuestos con una diferencia de punto de ebullición de al menos 50 oC pueden separarse de forma relativamente limpia.
Al final, unos cuantos consejos:
1. El vial cónico no debe llenarse más de la mitad para dejar espacio suficiente para la ebullición del líquido. De lo contrario, la solución se derramará o sobrepasará cuando empiece a hervir.
2. Un buen sellado entre las juntas minimiza la pérdida de compuesto objetivo durante la destilación. También evita el goteo de un compuesto sobre la placa caliente, y un posible accidente de incendio.