Solubilidad
¿Por qué algunos sólidos se disuelven en el agua?
El azúcar que utilizamos para endulzar el café o el té es un sólido molecular, en el que las moléculas individuales se mantienen unidas por fuerzas intermoleculares relativamente débiles. Cuando el azúcar se disuelve en el agua, los enlaces débiles entre las moléculas individuales de sacarosa se rompen, y estas moléculas de C12H22O11 se liberan en la solución.
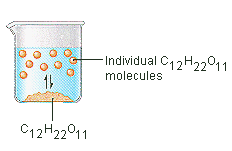
Se necesita energía para romper los enlaces entre las moléculas de C12H22O11 de la sacarosa. También se necesita energía para romper los enlaces de hidrógeno en el agua que deben ser interrumpidos para insertar una de estas moléculas de sacarosa en la solución. El azúcar se disuelve en el agua porque se desprende energía cuando las moléculas de sacarosa ligeramente polares forman enlaces intermoleculares con las moléculas de agua polares. Los enlaces débiles que se forman entre el soluto y el disolvente compensan la energía necesaria para alterar la estructura tanto del soluto puro como del disolvente. En el caso del azúcar y el agua, este proceso funciona tan bien que hasta 1800 gramos de sacarosa pueden disolverse en un litro de agua.
Los sólidos iónicos (o sales) contienen iones positivos y negativos, que se mantienen unidos por la fuerte fuerza de atracción entre partículas con cargas opuestas. Cuando uno de estos sólidos se disuelve en agua, los iones que forman el sólido se liberan en la solución, donde se asocian con las moléculas polares del disolvente.

| H2O | NaCl(s) | Na+(aq) | + | Cl-(aq) |
En general, podemos asumir que las sales se disocian en sus iones cuando se disuelven en el agua. Los compuestos iónicos se disuelven en agua si la energía que se desprende cuando los iones interactúan con las moléculas de agua compensa la energía necesaria para romper los enlaces iónicos en el sólido y la energía necesaria para separar las moléculas de agua para que los iones puedan introducirse en la solución.
![]()
Equilibrios de solubilidad
Las discusiones sobre los equilibrios de solubilidad se basan en la siguiente suposición: Cuando los sólidos se disuelven en el agua, se disocian para dar las partículas elementales de las que están formados. Por lo tanto, los sólidos moleculares se disocian para dar moléculas individuales
| H2O | C12H22O11(s) | C12H22O11(aq) |
y los sólidos iónicos se disocian para dar soluciones de los iones positivos y negativos que contienen.
| H2O | ||||
| NaCl(s) | Na+(aq) | + | Cl-(aq) |
Cuando se añade la sal por primera vez, se disuelve y se disocia rápidamente. Por lo tanto, la conductividad de la solución aumenta rápidamente al principio.
| disolver | . | NaCl(s) | Na+(aq) | + | Cl-(aq) |
| disociar |

Las concentraciones de estos iones pronto se vuelven lo suficientemente grandes como para que la reacción inversa comience a competir con la reacción hacia adelante, lo que conduce a una disminución de la velocidad a la que los iones Na+ y Cl- entran en la solución.
| se asocian | Cl-(aq) | NaCl(s) | |||||
| precipitado |
Eventualmente, las concentraciones de iones Na+ y Cl- se vuelven lo suficientemente grandes como para que la velocidad a la que se produce la precipitación equilibre exactamente la velocidad a la que se disuelve el NaC. Una vez que esto sucede, no hay ningún cambio en la concentración de estos iones con el tiempo y la reacción está en equilibrio. Cuando este sistema alcanza el equilibrio se denomina solución saturada, porque contiene la máxima concentración de iones que puede existir en equilibrio con la sal sólida. La cantidad de sal que debe añadirse a un volumen dado de disolvente para formar una solución saturada se llama solubilidad de la sal.
![]()
Reglas de solubilidad
Hay una serie de patrones en los datos obtenidos al medir la solubilidad de diferentes sales. Estos patrones constituyen la base de las reglas que se describen en la tabla siguiente, que pueden servir de guía para predecir si una sal determinada se disolverá en el agua. Estas reglas se basan en las siguientes definiciones de los términos soluble, insoluble y ligeramente soluble.
- Una sal es soluble si se disuelve en agua para dar una solución con una concentración de al menos 0,1 moles por litro a temperatura ambiente.
- Una sal es insoluble si la concentración de una solución acuosa es inferior a 0,001 M a temperatura ambiente.
- Las sales poco solubles dan soluciones que se encuentran entre estos extremos.
Reglas de solubilidad de los compuestos iónicos en el agua
![]()