De reis die de Franse astronoom Pierre Janssen in het voorjaar van 1868 ondernam van Europa naar de oostelijke Indiase provincie Madras, ging niet over één nacht ijs. Janssen reisde de halve wereld rond in de hoop de eerste persoon te worden die de komende zonsverduistering kon waarnemen met behulp van een nieuw wetenschappelijk instrument, de spectroscoop. Met dit nieuwe instrument hoopte hij nieuwe ontdekkingen te doen over de samenstelling van de zon – ervan uitgaande dat zware bewolking zijn uitzicht niet zou bederven.
Tijdens zijn reis, en de zorgelijke reeks regenachtige weersomstandigheden die voorafgingen aan de dag van de eclips, zou Janssen genoeg tijd hebben gehad om na te denken over de wetenschappelijke reuzen op wier schouders hij hoopte te staan. Aan de basis van deze menselijke piramide stond Isaac Newton zelf.
De ontdekking die Janssens missie in gang zette, was Newtons beroemde waarneming uit 1666 dat een bundel zonlicht die door een glazen prisma valt, zich in een regenboog van kleuren verspreidt. Wit licht, zo toonde Newton aan, was een mengsel van alle andere kleuren samen. Naarmate de technieken om het zonlicht te verspreiden echter werden verbeterd, bleek het zonnespectrum niet de perfecte kleurenreeks te zijn die het aanvankelijk leek. In 1814 stuurde de Duitse lenzenmaker en natuurkundige Josef von Fraunhofer het zonlicht door een smalle spleet voordat hij het door een glazen prisma liet gaan – en hij toonde aan dat Newtons regenboog vol met gaten zat.
Het was een eerste glimp van een nieuw element
Fraunhofers spleetvormige opstelling verspreidde het zonlicht effectiever dan een prisma alleen kon bewerkstelligen, waardoor niet minder dan 574 scherpe, donkere lijnen in het zonnespectrum zichtbaar werden. Maar pas in 1859 ontdekten de Duitsers Robert Bunsen en Gustav Kirchhoff waar de ontbrekende golflengten gebleven waren (zie Chemistry World, september 2013, p35). Kirchhoff vond een op prisma’s gebaseerd instrument uit – de spectroscoop – dat het duo gebruikte om aan te tonen dat sommige donkere lijnen in zonlicht exact overeenkwamen met het karakteristieke lijnenpatroon in het licht dat werd uitgezonden wanneer de zouten van pas ontdekte metalen zoals natrium en kalium in een vlam werden verbrand.
De wetenschappers toonden aan dat elk element zijn eigen patroon van golflengten absorbeerde en uitzond, zo uniek als een vingerafdruk – een effect waarvan we nu weten dat het wordt veroorzaakt door elektronen die licht absorberen of loslaten om opgewonden tussen energietoestanden te hoppen. Bunsen en Kirchhoff hadden bewezen dat de zon was samengesteld uit dezelfde chemische elementen als die op aarde. Met behulp van Kirchhofs spectroscoop ontdekten zij vervolgens twee onbekende elementen, rubidium en cesium, door residuen van mineraalwatermonsters te verbranden.
De race was begonnen om meer nieuwe elementen te vinden met behulp van de spectroscoop – wat in 1868 leidde tot Janssens missie om er een op de zon te richten. Door zijn experiment tijdens een eclips uit te voeren, hoopte Janssen de elementen te kunnen zien die rond de rand van de zon, in de atmosfeer, aanwezig waren.
Op de dag van de eclips trokken de wolken eindelijk weg. Toen de eclips begon en het die 18e augustus donker werd boven Madras, zag Janssen de toen al bekende emissielijnen van hete waterstof – en een heldergele lijn die nog nooit eerder was gezien. Het was een eerste glimp van een nieuw element, concludeerde Janssen.
Zoals al snel bleek, had je geen zonsverduistering nodig om deze opvallende gele lijn te zien. Een bewolkte herfstdag in de Britse universiteitsstad Cambridge voldeed ook. Op 20 oktober van dat jaar zag de Engelse astronoom Norman Lockyer, die niet op de hoogte was van Janssens waarnemingen, de gele lijn ook – en besloot dit onbekende chemische element helium te noemen, naar het Griekse woord voor de zon, helios.
De papieren van de twee mannen over hun waarnemingen arriveerden op dezelfde dag bij de Franse Academie van Wetenschappen in Parijs, en zo deelden zij de eer voor de ontdekking van een nieuw element.
Toen begonnen de problemen voor het duo.
Uitbreiding van het periodiek systeem
Niet iedereen was ervan overtuigd dat Janssen en Lockyer een nieuw chemisch element hadden ontdekt in de marge van de zon. Sommige wetenschappers maakten het idee van het hemellichaam ronduit belachelijk, wat alleen maar toenam naarmate de jaren verstreken en er geen spoor van helium op aarde werd gevonden. Zelfs Lockyer’s eigen assistent dacht dat de gele lijn een waarschijnlijk nog niet eerder ontdekte emissie van waterstof was.1
Bron: © Royal Society of Chemistry
William Ramsay vond helium op aarde – en krypton, neon en xenon
Prominent onder de ongelovigen was een nogal geduchte tegenstander, Dmitrii Mendelejev. De Russische chemicus was niet onbekend met vijandigheid en spot, aangezien hij meer dan een half decennium lang het slachtoffer was geweest van de publicatie van zijn periodiek systeem in 1869. Maar voor Mendelejev kwam de spectaculaire rechtvaardiging van zijn ontdekking in 1875, toen Paul-Emile Lecoq de Boisbaudran met behulp van een spectroscoop gallium ontdekte, een element waarvan het atoomgewicht perfect paste in een leemte in de tabel. De ontdekkingen van scandium en germanium kort daarna vulden nog meer gaten op. Maar geen van deze ontdekkingen hielp de zaak voor helium, omdat het periodiek systeem van die tijd geen gat had dat helium kon opvullen.
Het was een omissie die Mendeleev nog lang zou achtervolgen. In 1894 ontdekte de Engelse scheikundige William Ramsay een onreactief gas, dat hij argon noemde en dat vrijkwam bij verhitting van een mineraalmonster. Mendelejev wist niet goed wat hij moest denken van dit nieuwe element, dat niet door zijn periodiek systeem was voorspeld, en stelde dat Ramsay helemaal geen nieuw element had ontdekt, maar een nog niet eerder waargenomen drie-atomig stikstofmolecuul dat verwant was aan ozon (O3).
Maar in 1895, toen hij het verhittingsexperiment met een uraniummineraal herhaalde, isoleerde Ramsay een ander inert gas. Dit gas produceerde een spectraallijn die exact overeenkwam met die welke Janssen en Lockyer in de zon hadden waargenomen. Ramsay had helium op aarde gevonden. Ramsay ontdekte weldra ook krypton, neon en xenon – alle opmerkelijk onreactief. De complete nieuwe reeks elementen overtuigde Mendelejev ervan dat het periodiek systeem moest worden uitgebreid.
De edelgassen, aangevoerd door helium, staan nu helemaal rechts in het systeem, een positie die hun keurig gevulde buitenste schil van elektronen weerspiegelt. Deze zeer stabiele plaatsing van de elektronen is de reden voor de opmerkelijk lage chemische reactiviteit van deze elementen, waarbij helium het meest onreactieve element van allemaal is.
Ramsay’s ontdekking van een hele nieuwe familie van elementen die aan de rechterkant van het periodiek systeem moesten worden geplaatst, leverde hem de Nobelprijs voor scheikunde van 1904 op. Volgens sommigen heeft diezelfde ontdekking tegelijkertijd Mendelejevs eigen kansen op de prijs om zeep geholpen.1 Ondanks zijn opmerkelijke bijdrage aan de wetenschap heeft de Russische scheikundige nooit de Nobelprijs gekregen.
Op en weg
Het was geen gelukkig toeval dat Ramsay helium isoleerde uit een uraniumrijk mineraal. Het langzame verval van radioactieve uranium- en thoriumkernen is tegenwoordig de belangrijkste bron van helium op onze planeet. Verscheidene uranium- en thoriumisotopen vervallen door de uitzending van alfadeeltjes – een kleine cluster van subatomaire deeltjes bestaande uit twee protonen en twee neutronen. Deze combinatie van subatomaire deeltjes is precies de set waaruit de heliumkern is opgebouwd.
In het heelal is helium na waterstof het meest voorkomende element. Het grootste deel van dit helium is afkomstig uit een korte periode een paar minuten na de oerknal, toen de temperatuur voldoende was afgekoeld om kleine clusters van subatomaire deeltjes de eerste atoomkernen te laten vormen. Zo’n 380.000 jaar later koelde het heelal uiteindelijk voldoende af om deze kernen elektronen te laten vangen en zo de eerste atomen te vormen – voornamelijk waterstof en helium, die vandaag de dag nog steeds het heelal domineren.
Op aarde is het echter een ander verhaal. Helium is zo licht dat het niet door de zwaartekracht van de aarde wordt tegengehouden. Omdat het inert is, wordt het ook niet door de chemie in bedwang gehouden. Het helium dat aanwezig was toen de aarde werd gevormd, is weggedreven in de ruimte. Jupiter en Saturnus, grotere planeten met een sterkere zwaartekracht, hielden hun helium vast en het is een belangrijk bestanddeel van de samenstelling van de gasreuzen. Zoals Lockyer en Janssen opmerkten, is het ook een belangrijk bestanddeel van de atmosfeer van de zon.
Toen Ramsay de edelgassen ontdekte, vonden sommige leden van de familie al snel toepassingen. Een van de eerste experimenten die de scheikundige in zijn laboratoria aan het University College in Londen met het pas geïsoleerde neon uitvoerde, was de excitatie ervan met een elektrode. Het gas gaf een verbluffende rode gloed af die weldra de straten van Parijs en Los Angeles verlichtte in de vorm van reclameborden.

Bron: © Michael Helliwell/Alamy Stock Photo
Zijn luchtschepen aan een comeback toe?
Helium had wat meer tijd nodig om een toepassing te vinden. Het proces werd uiteindelijk versneld door het uitbreken van de eerste wereldoorlog.2 De militaire zeppelinballonnen van Duitsland vestigden de aandacht van het Britse en Amerikaanse leger op gassen die lichter waren dan lucht. Helium kon de hefkracht van waterstof niet evenaren, maar had het grote voordeel dat het chemisch inert was en niet zou verbranden als het door vijandelijk vuur werd geraakt. Een tiental jaren voor het uitbreken van de oorlog had men ontdekt dat helium van nature aanwezig was in sommige aardgaslagen, met name in Texas. Toen de VS in de oorlog belandde, gaf het Bureau of Mines contracten uit voor de bouw van drie heliumextractiefabrieken.
Toen luchtschepen al snel werden vervangen door vliegtuigen voor militaire en commerciële vluchten, kwam het gebruik van helium als lichter dan luchtgas niet helemaal van de grond zoals verwacht – hoewel het tegenwoordig wordt gebruikt voor het vullen van ballonnen voor wetenschappelijk onderzoek op grote hoogte, en voor feestballonnen. Tientallen jaren lang produceerde de VS veel meer helium dan ze gebruikte, dat ze ondergronds opsloeg in uitgeputte gasvelden.
In 1996 kondigde de regering van de VS een grootscheepse verkoop van het opgeslagen gas aan – tot grote bezorgdheid van wetenschappers – om de aanzienlijke schuld die ze had opgebouwd door al dit helium op te kopen en op te slaan, terug te verdienen. Tegen die tijd was de vraag naar helium enorm gestegen. Door zijn inerte aard werd het gebruikt voor het creëren van een beschermende atmosfeer bij de vervaardiging van optische vezels en halfgeleiders, en bijvoorbeeld voor booglassen. Veel belangrijker was dat helium onmisbaar was geworden voor moderne medische beeldvormingsapparatuur en om ons te helpen de diepe mysteries van de kosmos te onderzoeken. Omdat helium het laagste kookpunt heeft van alle elementen, een ultrakille -269°C, is het een essentieel koelmiddel voor de zeer lage temperaturen die nodig zijn voor de supergeleidende elektromagneten die worden gebruikt in MRI-machines in ziekenhuizen. Om dezelfde reden koelt het de magneten van de Large Hadron Collider, evenals sommige NMR-machines.
Als helium eenmaal in de lucht ontsnapt, is dit lichte gas voorgoed verdwenen. In 2015 vreesde de British Medical Association dat de heliumvoorziening spoedig zou moeten worden gereguleerd om de aanvoer van het gas op middellange en lange termijn te garanderen. Maar dat jaar gebruikte een team van de Britse universiteiten van Oxford en Durham, in samenwerking met heliumexploratiebedrijf Helium One, een nieuwe methode van systematisch zoeken om voor het eerst een natuurlijke heliumbron te ontdekken.

Bronnen: Noel Feans (Oldupai) / CC BY 2.0
Het veelbesproken heliumtekort zou kunnen worden afgewend door het gas te winnen uit de Rift Valley in Tanzania
De enorme heliumvondst bevindt zich in de Rift Valley in Tanzania, waar in de jaren vijftig van de vorige eeuw voor het eerst heliumzeepbellen waren ontdekt. Het team gebruikte technieken voor olie-exploratie, waarbij factoren als gesteentetype werden beoordeeld, maar toonde aan dat de sleutel tot aanpassing van de technieken voor helium-exploratie lag in het rekening houden met de aanwezigheid van nabijgelegen actieve vulkanen. Vulkanische activiteit levert waarschijnlijk de warmte die nodig is om het helium vrij te laten komen dat zich in oude gesteenten heeft opgehoopt”, aldus Diveena Danabalan, een lid van het Durham-team. Maar de locatie van de vulkaan heeft een goudlokje-dimensie, voegt ze eraan toe. Als de gasvallen te dicht bij een bepaalde vulkaan liggen, lopen ze het risico dat helium sterk wordt verdund door vulkanische gassen zoals kooldioxide’.
Sommige van de gasvallen die het team heeft bemonsterd, bevatten tussen 8% en 10% helium, een veel hoger percentage dan de heliumlocaties die momenteel worden geëxploiteerd.3 Volgens Helium One wordt de hoeveelheid helium in de tot nu toe onderzochte Rift Valley-locaties geschat op bijna 100 miljard kubieke voet (2,8 miljard kubieke meter), niet ver van de huidige Amerikaanse reserve van 153 miljard kubieke voet.
De dreigende heliumcrisis lijkt voorlopig te zijn afgewend.
Onder druk
Ochemisch gezien laat helium niet veel te melden over. Helium is het meest niet-reactieve element op het periodiek systeem, met een recordhoog ionisatiepotentieel en een elektronenaffiniteit van vrijwel nul. Terwijl andere edelgassen tot enige scheikunde zijn overgehaald, vooral met zeer elektronegatieve elementen zoals fluor, heeft helium zich daartegen verzet – tot voor kort.
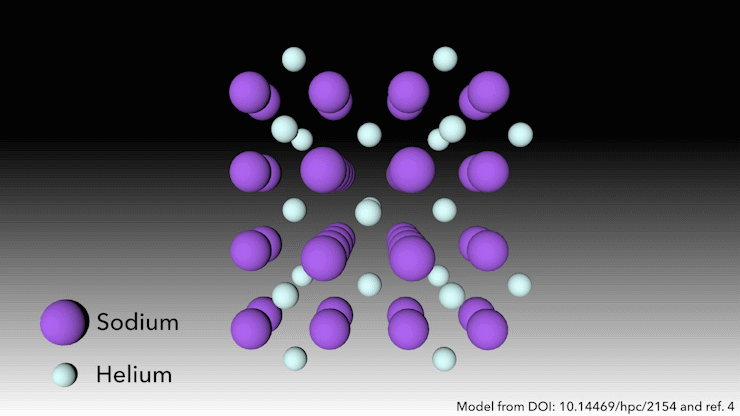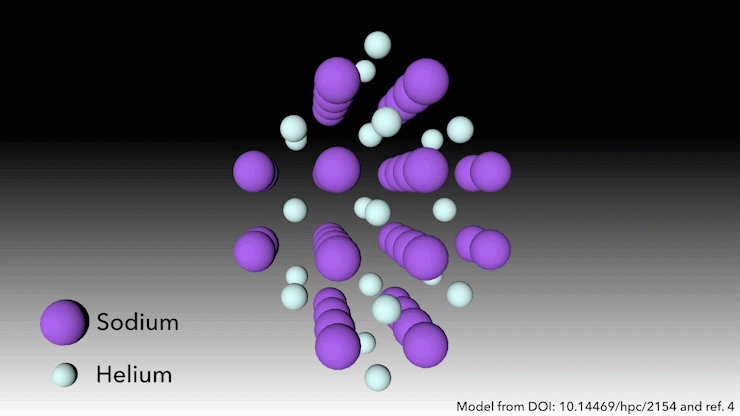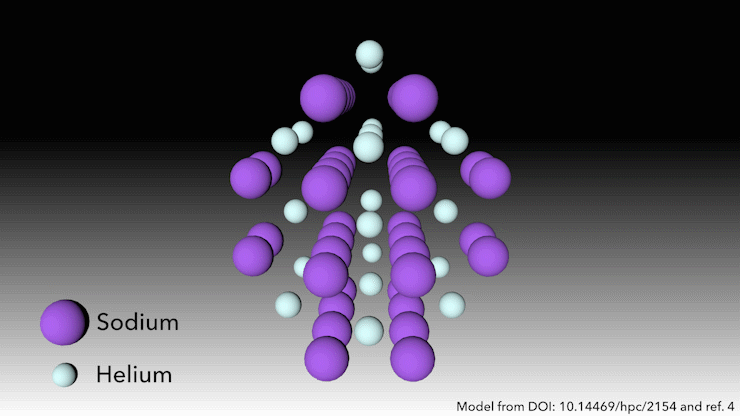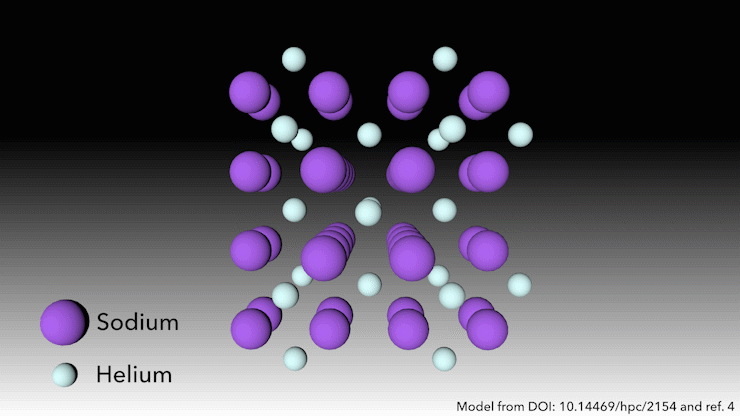
Bron: © Royal Chemistry of Chemistry
Wie zegt dat helium geen verbindingen vormt?
In 2017 toonde een internationaal team aan dat helium een stabiele verbinding in vaste toestand vormt wanneer het wordt gemengd met natrium.4 Je hoeft er alleen maar hard genoeg in te knijpen. ‘Bij zeer hoge druk gebeurt er iets raars,’ zegt Richard Dronskowski van de Universiteit van Aken in Duitsland, die deel uitmaakte van het team.
Bij een druk van meer dan 113 gigapascal – meer dan een miljoen atmosfeer – worden de natriumatomen in de structuur zo hard samengeperst dat ze hun valantie-elektron uitspugen. Het natriumkation is veel kleiner dan het natriumatoom – maar dan is de vraag: waar laten we het elektron? zegt Dronskowski. Dat is waar de heliumatomen om de hoek komen kijken. Het helium is de afstandhouder – het accepteert geen elektronen, maar het houdt het natriumkation en het negatief geladen elektron uit elkaars buurt. Paren elektronen zitten in gaten in de structuur die de heliumatomen helpen creëren.
Deze vreemde heliumverbinding, die de formule Na2He heeft, is het eerste voorbeeld van een materiaal in vaste toestand waarin een atoom als afstandhouder fungeert om een atoom te helpen disproportioneren in een kation en elektron, zegt Dronskowski. Maar in andere opzichten is het materiaal heel bekend, voegt hij eraan toe. In een notendop is het een zout, net als tafelzout. Het heeft een kristalstructuur die heel bekend is in de vastestofchemie.’
En helium – dat volkomen inert zou zijn – blijft verrassen en tot nieuwe scheikundige inzichten leiden. Het waren computerprognoses – veel gemakkelijker uit te voeren dan dure en tijdrovende hogedrukexperimenten – die voor het eerst suggereerden dat Na2He zou kunnen bestaan. Nieuwe berekeningen tonen aan dat helium in feite een hele reeks verbindingen zou kunnen vormen, waarvan sommige stabiel zouden kunnen zijn bij drukken van slechts 30 gigapascal.5
Over de grenzen van ons zonnestelsel
Het bestuderen van de chemie in de kosmos, door te zoeken naar de verraderlijke afdruk van spectraallijnen in het licht dat de aarde bereikt, is vandaag de dag nog net zo’n belangrijk onderwerp van onderzoek als in de tijd van Janssen en Lockyer.
Precies 150 jaar nadat de twee astronomen de heldergele emissielijn ontdekten die voor de mensheid de eerste glimp van helium opleverde, heeft een Brits team van onderzoekers voor het eerst helium geïdentificeerd in de atmosfeer van een exoplaneet.6 Het proces dat wij gebruikten en dat van Lockyer is eigenlijk vrij gelijkaardig,’ zegt Jessica Spake van de Universiteit van Exeter, die het onderzoek leidde. ‘De gele lijn die Lockyer vond, en de lijn die wij vonden in het nabij-infrarood, komen allebei van aangeslagen helium.’

Bron: (c) ESA/Hubble, NASA, M. Kornmesser
Wetenschappers hebben helium gevonden in de ontsnappende atmosfeer van exoplaneet WASP-107b
Hoewel algemeen werd verwacht dat helium aanwezig zou zijn in de atmosfeer van planeten die in een baan om verre zonnen draaien – net als in de atmosferen van planeten in ons eigen zonnestelsel – waren er twee hindernissen die ons ervan weerhielden het te detecteren, legt Spake uit. Ten eerste zijn er maar weinig detectoren die in het nabij-infraroodspectrum werken. Ten tweede hebben de watermoleculen in de atmosfeer van de aarde emissielijnen die het heliumsignaal vertroebelen. Het is een lastig golflengtegebied om in te werken”, zegt Spake. Als gevolg daarvan raakte de jacht op helium uit de mode.
De studie van Spake brengt het element weer in de mode. Met behulp van de nabij-infrarooddetector van de Hubble-ruimtetelescoop ontdekte Spake het heliumsignaal toen exoplaneet WASP-107b voor zijn ster langs trok en een deel van het licht van de ster door de heliumrijke bovenatmosfeer van de planeet viel. Dat sterlicht bracht de kenmerkende emissieband van helium helemaal naar de aarde.
‘Het spannende is dat er het komende jaar veel spectrografen met hoge resolutie online komen die deze golflengte bestrijken, dus dit is het perfecte moment om naar helium te zoeken,’ zegt Spake.
Een van de vreemdste bevindingen van de exoplaneetwetenschap tot nu toe is dat het meest voorkomende type planeet in het melkwegstelsel superaardes en mini-Neptunes zijn – een type planeet waarvan we geen idee hadden dat het bestond, omdat ze niet in ons eigen zonnestelsel voorkomen. In ons zonnestelsel hebben we kleine rotsachtige planeten en grotere ijsreuzen – deze exoplaneten vallen daar tussenin,’ zegt Spake. ‘We weten niet waar ze van gemaakt zijn.’ Een mogelijkheid is dat ze bestaan uit een rotsachtige kern, omgeven door een grote waterstof- en heliumenvelop. De andere toonaangevende theorie is dat ze voornamelijk uit water bestaan. Door hun heliumsignaal te meten, kan duidelijk worden waar de meest voorkomende planeten in het melkwegstelsel van zijn gemaakt.
En dan is er nog de mogelijkheid om helium te gebruiken om verre aardes te identificeren. Door hun geringe afmetingen zijn rotsachtige planeten zoals de onze moeilijk te herkennen in een baan rond verre sterren. Maar omdat de heliumemissie afkomstig is van de bovenste atmosfeer van planeten, lijkt de planeet op deze golflengte tot drie keer groter dan op optische golflengten, zegt Spake. Door op deze golflengte op exoplanten te jagen, zouden kleinere planeten gemakkelijker te vinden moeten zijn. De James Webb-ruimtetelescoop, die in mei 2020 wordt gelanceerd, zou met deze techniek exoplaneten ter grootte van de aarde moeten kunnen oppikken.
‘We denken dat helium enorm belangrijk is,’ zegt Spake. We hopen dat het de komende jaren veel meer zal worden gebruikt.’
James Mitchell Crow is een wetenschapschrijver uit Melbourne, Australië