Doelstellingen
Na het voltooien van dit onderdeel moet je in staat zijn om
- een vergelijking te schrijven om de vorming van een cyanohydrine uit een aldehyde of keton te beschrijven.
- de cyanohydrine identificeren die wordt gevormd uit de reactie van een bepaald aldehyde of keton met waterstofcyanide.
- benoem het aldehyde of keton, de reagentia, of beide, die nodig zijn om een gegeven cyanohydrine te bereiden.
- schrijf het gedetailleerde mechanisme voor de additie van waterstofcyanide aan een aldehyde of keton.
Kernbegrippen
Zorg ervoor dat je de onderstaande kernbegrippen kunt definiëren, en in context kunt gebruiken.
- cyanohydrine
Studienotities
Voor een succesvolle vorming van cyanohydrine is het belangrijk dat er vrije cyanide-ionen beschikbaar zijn om met het keton of aldehyde te reageren. Dit kan worden bereikt door een zout (bijvoorbeeld KCN of NaCN) of een gesilyleerde (bijvoorbeeld Me3SiCN) vorm van cyanide te gebruiken onder zure omstandigheden of door HCN te gebruiken waaraan een base is toegevoegd om het benodigde CN- nucleofiel te produceren.
Waterstofcyanide (HC≡N), voegt zich omkeerbaar toe aan aldehyden en veel ketonen, waarbij hydroxyalkanenitril-adducten worden gevormd (algemeen bekend en cyanohydrinen genoemd). Cyanohydrinen hebben de structuurformule R2C(OH)CN. De “R” in de formule staat voor een alkyl, aryl of waterstof.
Figuur 19.6.1: Algemene reactie van cyanohydrinevorming
Een belangrijk kenmerk van cyanohydrinevorming is dat er een basische katalysator voor nodig is. Aangezien waterstofcyanide zelf een zuur is (pKa = 9,25), treden de beste resultaten op wanneer een kleine hoeveelheid van een sterke base waterstofcyanide activeert door het om te zetten in cyanide-ion ((-)C≡N), dat kan fungeren als nucleofiel voor koolstof. Bij afwezigheid van een base verloopt de reactie niet of in het beste geval zeer langzaam. De vorming van cyanohydrine is zwak exotherm, en is gunstig voor aldehyden, en ongehinderde cyclische en methylketonen.
Bij praktische syntheses van cyanohydrinen is het handig een sterk zuur toe te voegen aan een mengsel van natriumcyanide en de carbonylverbinding, zodat in situ waterstofcyanide ontstaat. De hoeveelheid toegevoegd zuur moet onvoldoende zijn om al het cyanide-ion te verbruiken, zodat voldoende alkalische omstandigheden worden gehandhaafd voor een snelle toevoeging.
Ook is aangetoond dat zuur-gekatalyseerde hydrolyse van gesilyleerde cyanohydrinen (R3SiCN) een bron van waterstofcyanide is om cyanohydrinen te vormen, zelfs met sterk gehinderde ketonen.
2 (CH3)3SiCN + H2O → (CH3)3SiOSi(CH3)3 + 2 HCN
Waterstofcyanide voegt zich over de koolstof-zuurstof dubbele binding in aldehyden en ketonen om verbindingen te produceren die bekend staan als hydroxynitriles. Bijvoorbeeld, met ethanal (een aldehyde) krijg je 2-hydroxypropanenitril:
Met propanon (een keton) krijg je 2-hydroxy-2-methylpropanenitril:
De reactie wordt normaal gesproken niet gedaan met waterstofcyanide zelf, omdat dit een uiterst giftig gas is. In plaats daarvan wordt het aldehyde of keton gemengd met een oplossing van natrium- of kaliumcyanide in water waaraan een beetje zwavelzuur is toegevoegd. De pH van de oplossing wordt op ongeveer 4 – 5 gebracht, omdat dit de snelste reactie geeft. De oplossing zal waterstofcyanide bevatten (afkomstig van de reactie tussen het natrium- of kaliumcyanide en het zwavelzuur), maar bevat nog enkele vrije cyanide-ionen. Dit is belangrijk voor het mechanisme.
Mechanisme van de vorming van cyanohydrine
1) In de eerste stap fungeert het cyanide-ion als nucleofiel en vormt een binding met de elektrofiele carbonylkoolstof. De twee elektronen in de carbonyl-pi-binding worden doorgedrukt naar de elektronegatieve zuurstof, waardoor een tetrahedraal alkoxide-ion intermediair wordt gevormd.
2) Het alkoxide-ion wordt geprotoneerd door HCN, waardoor het cyanide-ion wordt geregenereerd.
Volgende chemie van cyanohydrinen
Cyanohydrine functionele groepen blijken vaak nuttig vanwege de verdere chemie die kan worden uitgevoerd als gevolg van de aanwezigheid van een hydroxyl- en nitrillenfunctionaliteit. In het bijzonder kan de hydroxylgroep door dehydratie worden omgezet in een alkeen (paragraaf 17.6). De nitril kan worden omgezet in een carboxylzuur-functiegroep door reactie met een hete zure waterige oplossing (paragraaf 20.7). Ook kan de nitril worden gereduceerd door toevoeging van LiAlH4 om een primair amine te vormen. Door de vorming van een cyanohydrine kunnen aldehyden en ketonen gemakkelijk worden omgezet in een grote verscheidenheid van functionele groepen.
Andere cyanohydrinen
Andere interessante cyanohydrinen zijn: mandelonitril, aceton cyanohydrine, en glycolonitril.
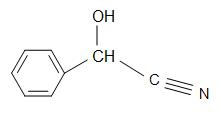

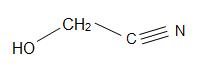
Structuren van Madelonitril (links), aceton cyanohydrine (midden), en glycolonitril (rechts)
Mandelonitril heeft een structuurformule van C6H5CH(OH)CN en komt voor in de pitten van sommige vruchten. Aceton cyanohydrine heeft de structuur, (CH3)2C(OH)CN, en wordt gebruikt bij de productie van methylmethacrylaat (ook bekend als acrylaat). Glycolonitril is een organische verbinding met als structuurformule HOCH2CN, de eenvoudigste cyanohydrine die door formaldehyden wordt afgeleid.
Problemen
Vul de volgende reacties voor cyanohydrinen in:
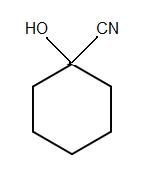
1)
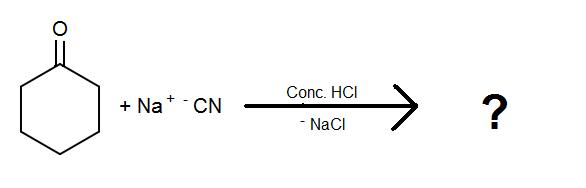
2)
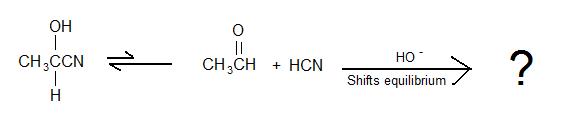
3) Waar of Onwaar: Voor de vorming van een cyanohydrine wordt een snelle additon van sterk zuur aan cyanidezout uitgevoerd om het zout om te zetten in HCN.
4) Waar of Onwaar: Cyanohydrinereacties zijn irreversibel.
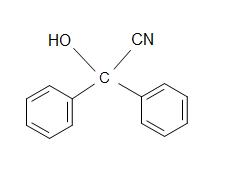
5) Wat is het product voor de totale reactie?
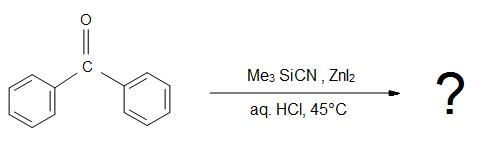
Antwoorden
1)
2)
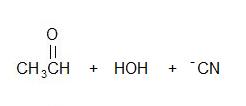
3) False, langzame optelling
4) Vals, omkeerbaar
5)
Inbrengers en toeschrijvingen
-
Dr. Dietmar Kennepohl FCIC (hoogleraar scheikunde, Athabasca University)
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, emeritus hoogleraar (Michigan State U.), Virtual Textbook of Organic Chemistry
-
Jim Clark (Chemguide.co.uk)