Cyclofosfamide, ook wel Cytoxan genoemd, wordt geclassificeerd als een “cytotoxisch middel”, omdat het een toxische werking heeft op vele soorten cellen (“goede” cellen zowel als “slechte”). Cyclofosfamide is een van een aantal geneesmiddelen die voor het eerst zijn ontwikkeld als chemotherapeutisch middel (een geneesmiddel dat wordt gebruikt bij de behandeling van kanker). Men ontdekte dat cyclofosfamide – naast zijn nut bij kanker – ook een belangrijk vermogen heeft om het immuunsysteem te onderdrukken. Het geneesmiddel is dus zeer doeltreffend bij de behandeling van immunologisch-gemedieerde ziekten, waaronder sommige vormen van vasculitis. In het algemeen worden voor de behandeling van vasculitis veel lagere doses cyclofosfamide gebruikt dan voor de behandeling van kanker. De doses cyclofosfamide die worden gebruikt voor de behandeling van vasculitis zijn echter nog steeds hoog genoeg om een aanzienlijk aantal bijwerkingen te veroorzaken, en het geneesmiddel moet met grote voorzichtigheid worden gebruikt.
In deze paragraaf bespreken we de bijwerkingen van cyclofosfamide. Na het doorlezen van de vele mogelijke bijwerkingen zou een redelijk mens kunnen concluderen dat de behandeling erger lijkt dan de ziekte die men ermee wil behandelen! Wij benadrukken echter dat voor sommige vormen van vasculitis die niet reageren op steroïden (prednison) alleen, cyclofosfamide een levensreddend medicijn kan zijn. Vóór de introductie van cyclofosfamide bij de behandeling van granulomatose van Wegener in de jaren zeventig bijvoorbeeld, was de ziekte van Wegener bijna altijd een fatale ziekte, zelfs met hoge doses steroïden. Nu, met de combinatie van cyclofosfamide en prednison, reageert meer dan 90% van de patiënten met de ziekte van Wegener op de behandeling, en 75% komt in een ziekte-remissie. Andere typen vasculitis waarbij cyclofosfamide soms wordt gebruikt zijn: polyarteritis nodosa, microscopische polyangiitis, het syndroom van Churg-Strauss, cryoglobulinemie, vasculitis van het centrale zenuwstelsel, reumatoïde vasculitis, en andere typen vasculitis die refractair zijn voor prednison en andere medicijnen.
Cyclofosfamide wordt meestal gebruikt in combinatie met steroïden (prednison). Het helpt vaak de doses steroïden te verlagen die nodig zijn om vasculitis onder controle te krijgen. In dit opzicht wordt cyclofosfamide soms een “steroïd-sparend middel” genoemd. De mogelijke bijwerkingen van cyclofosfamide verschillen voor het grootste deel van die van prednison. Zo wordt cyclofosfamide, in tegenstelling tot prednison, NIET in verband gebracht met gewichtstoename, botverdunning, verhoogde bloeddruk of een neiging tot het opwekken van suikerziekte. Cyclofosfamide verhoogt echter wel aanzienlijk het risico van een patiënt op bepaalde soorten infecties (zie hieronder) en heeft verschillende andere potentieel zeer ernstige bijwerkingen, waaronder een verhoogde aanleg voor bepaalde vormen van kanker. We bespreken de mogelijke bijwerkingen van cyclofosfamide hieronder.
Bijwerkingen
Cyclofosfamide kan zowel intraveneus (ongeveer eenmaal per maand) als oraal (eenmaal per dag, meestal in een kleinere dosis) worden toegediend. Tot op zekere hoogte verschillen de bijwerkingen van cyclofosfamide al naar gelang de wijze waarop het middel wordt toegediend.
- Infectie
- Onttrekking van het beenmerg
- Kanker
- Blaasproblemen
- Onvruchtbaarheid
Infectie
Cyclofosfamide verhoogt het risico op “opportunistische” infecties, d.w.z. infecties die het intacte immuunsysteem van een persoon normaal gesproken zou kunnen afweren. Cyclofosfamide verhoogt dus niet de gevoeligheid van een patiënt voor een gewone verkoudheid, maar wel het risico op ernstiger infecties, waaronder tuberculose, schimmelinfecties en ernstige virale infecties. Hieronder worden enkele specifieke infecties beschreven die vaak in verband worden gebracht met het gebruik van cyclofosfamide (of het gebruik van immunosuppressieve geneesmiddelen in het algemeen):
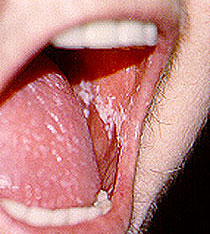
“Spruw” – Spruw is een schimmelinfectie van de mond die wordt veroorzaakt door Candida. Het verschijnt meestal als witte vlekken aan de binnenkant van de mond (zie foto hieronder), en is gemakkelijk te behandelen met het gebruik van anti-schimmel mondwater of tabletten. Soms hebben Candida-infecties ook invloed op de slokdarm (de “voedselbuis” die van de mond naar de maag loopt). Deze aandoening, die “Candida esophagitis” wordt genoemd, leidt vaak tot pijn bij het slikken en moet worden behandeld met krachtige antischimmelmedicijnen zoals fluconazol.
“Gordelroos” – of Herpes zoster. “Gordelroos” is het gevolg van de reactivering van het virus dat waterpokken veroorzaakt (Varicella zoster). Bijna iedereen die nu ouder is dan 5 jaar heeft wel eens waterpokken gehad, meestal als kind. Normaal gesproken, zelfs nadat de uitslag en andere symptomen van waterpokken zijn verdwenen, blijft het virus dat de ziekte heeft veroorzaakt in een “slapende” toestand in het lichaam aanwezig, verstopt in de wortel van een van de zenuwen langs de wervelkolom. Tientallen jaren later, als het immuunsysteem enigszins afneemt met de leeftijd (een normaal onderdeel van het verouderingsproces) of als het immuunsysteem wordt onderdrukt (door medicijnen zoals cyclofosfamide), wordt het virus weer actief. Wanneer het virus weer actief wordt, veroorzaakt Varicella zoster meestal een pijnlijke uitslag op de plaats van een enkele zenuw, zoals aan één kant van het gezicht of langs een arm. De uitslag wordt gekenmerkt door groepjes kleine blaasjes (blaren) die op een basis van rode huid zitten, en kan uiterst pijnlijk zijn.
“Gordelroos” is te behandelen met antivirale geneesmiddelen zoals acyclovir of famcyclovir. Deze moeten zo snel mogelijk worden toegediend. Verdovende pijnstillers kunnen ook gedurende enkele weken nodig zijn. In een kleine minderheid van de gevallen leidt gordelroos tot pijn die maanden kan aanhouden. Deze aandoening wordt “post-herpetische neuralgie” genoemd.
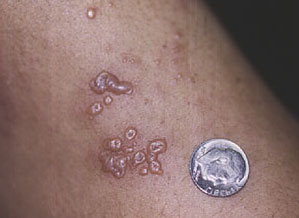
Een voorbeeld van de klassieke uitslag van “gordelroos”.
Pneumocystis carinii pneumonia (“PCP”) – Pneumocystis carinii is een schimmel die zich in de longen van de meeste mensen bevindt. Mensen met een intact immuunsysteem hebben geen moeite om het organisme op afstand te houden. Bij patiënten met een onderdrukt immuunsysteem kan het organisme een ernstige vorm van longontsteking veroorzaken: PCP. Een paar jaar geleden was PCP de meest voorkomende oorzaak van ernstige longinfecties bij patiënten met AIDS. Door de vooruitgang in de behandeling en preventie van deze aandoening is PCP nu een veel zeldzamer probleem bij AIDS. Ook bij patiënten met vasculitis kan PCP worden voorkomen door de patiënten dagelijks of om de dag bepaalde soorten antibiotica te laten innemen. De antibiotica die hiervoor het meest worden gebruikt zijn trimethoprim-sulfamethoxazol (Bactrim, Septra) of, bij patiënten die allergisch zijn voor sulfamiddelen, dapsone.
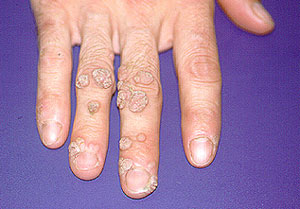
Wratten – De foto hieronder toont een woekering van wratten bij een vasculitispatiënt die immunosuppressie ondergaat. De ontwikkeling van wratten in deze mate is vrij ongebruikelijk.
Onderdrukking van het beenmerg
Het beenmerg is het orgaan van het lichaam dat rode bloedcellen (die zuurstof vervoeren), witte bloedcellen (die infecties bestrijden) en bloedplaatjes (die helpen bij de bloedstolling) aanmaakt. Bijna alle patiënten die met cyclofosfamide worden behandeld, ondervinden enige onderdrukking van het vermogen van het beenmerg om deze vitale bloedelementen te produceren. Daarom is een zorgvuldige controle van de bloedwaarden essentieel tijdens de behandeling met cyclofosfamide. Onderdrukking van het beenmerg door cyclofosfamide is meestal van voorbijgaande aard – d.w.z. dat het reageert op verlaging van de dosis of stopzetting van het medicijn – maar gevaarlijk lage niveaus van een van deze drie cellijnen (of zelfs permanent beenmergfalen) kunnen voorkomen.
De witte bloedcellen zijn de cellijn die gewoonlijk het meest gevoelig is voor de effecten van cyclofosfamide. Wanneer cyclofosfamide intraveneus wordt toegediend, bereikt het aantal witte bloedcellen gewoonlijk zijn dieptepunt (“nadir”) tussen 7 en 14 dagen na toediening. Daarom moet het aantal bloedcellen ongeveer 10 dagen na de toediening van cyclofosfamide worden gemeten, en zo vaak als nodig herhaald worden om er zeker van te zijn dat het aantal niet te laag wordt. Dit betekent normaal gesproken dat het bloed elke 2-4 weken wordt gecontroleerd. Wanneer cyclofosfamide oraal wordt toegediend (d.w.z. elke dag, in plaats van eenmaal per maand), moet het bloedbeeld ongeveer 7 dagen na het begin van de behandeling worden gecontroleerd en vervolgens ten minste eenmaal per 3 weken. In sommige centra die ervaring hebben met de zorg voor patiënten met vasculitis en met het gebruik van cyclofosfamide, worden de bloedwaarden elke 2 weken gecontroleerd.
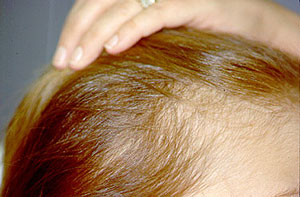
Afgebeeld is een vrouw met microscopische polyangiitis die werd behandeld met intraveneuze cyclofosfamide en hoge doses corticosteroïden. Na verschillende cyclofosfamidebehandelingen werd haar haar duidelijk (omkeerbaar) dunner.
Kanker
Veel van de bijwerkingen van cyclofosfamide treden hoogstwaarschijnlijk op terwijl de patiënt de medicatie inneemt. Bij deze bijwerkingen neemt het risico sterk af na het staken van het medicijn. Daarentegen kan het risico op kanker als gevolg van het gebruik van cyclofoshamide nog vele jaren voortduren, zelfs nadat patiënten met de medicatie zijn gestopt. Het risico op kanker lijkt afhankelijk te zijn van de duur van het medicijngebruik en de cumulatieve dosering van het geneesmiddel. Patiënten die cyclofosfamide hebben gebruikt, hebben een verhoogd risico op ten minste twee primaire soorten maligniteit: leukemie/lymfoom en blaaskanker. Er kunnen ook verhoogde risico’s zijn voor andere soorten kanker, maar de risico’s zijn minder hoog.
Leukemie/lymfoom – Een van de bijwerkingen op lange termijn van het gebruik van cyclofosfamide is een aanzienlijke verhoging van het risico op beenmerg- en lymfeklierkanker (respectievelijk bekend als leukemie en lymfoom). Artsen zijn momenteel niet in staat te voorspellen welke patiënten risico lopen op deze complicaties. De beste manier om deze soorten kanker te voorkomen is een oordeelkundig gebruik van cyclofosfamide: de laagst mogelijke dosis van het geneesmiddel gedurende de kortst mogelijke tijd die nodig is om de ziekte onder controle te houden.
Blaaskanker – Cyclofosfamide heeft de neiging de blaas te beschadigen (zie Blaasproblemen, hieronder). Deze beschadiging maakt patiënten vatbaar voor de ontwikkeling van blaaskanker. Het risico op blaaskanker (en op andere complicaties van de blaas) is groter wanneer cyclofosfamide wordt toegediend in de orale dagelijkse vorm. Onder patiënten met Wegener’s granulomatosis die werden behandeld met oraal dagelijks cyclofosfamide aan het National Institutes of Health, was het risico op blaaskanker 6%. Onder patiënten die tot 15 jaar werden gevolgd, was de verwachte incidentie van blaaskanker maar liefst 16%. Daarom moeten patiënten die met cyclofosfamide zijn behandeld voor onbepaalde tijd worden gevolgd voor de mogelijkheid van blaascomplicaties van de behandeling. De beste methode om op deze complicatie te screenen is het controleren op rode bloedcellen in de urine door het verrichten van een urineonderzoek, gevolgd door cystoscopie als er rode bloedcellen aanwezig zijn. Patiënten bij wie blaasbeschadiging door cyclofoshamide is aangetoond, d.w.z. die een door het geneesmiddel veroorzaakte cystitis hebben, moeten regelmatig een cystoscopie ondergaan met een door hun uroloog te bepalen interval.
Wanneer cyclofosfamide intraveneus wordt toegediend, kan tegelijkertijd een blaasbeschermend geneesmiddel, MESNA genaamd, worden toegediend. MESNA lijkt de toxische metaboliet van cyclofosfamide (acroleïne), die verantwoordelijk wordt geacht voor de blaascomplicaties, te neutraliseren. Bijkomende strategieën om de blaastoxiciteit van cyclofosfamide te verminderen zijn onder meer 1) het geven van intraveneuze hydratatie voorafgaand aan cyclofosfamide; 2) het innemen van alle medicijnen in één enkele ochtenddosis en deze wegspoelen met een grote hoeveelheid vloeistof; en 3) het drinken van ruime hoeveelheden vloeistof gedurende de dag (acht 8-ounce glazen water) om een levendige urineproductie te handhaven.
Blaasproblemen
Naast kanker kan cyclofosfamide een wisselende hoeveelheid bloedingen uit de blaas veroorzaken, een complicatie die bekend staat als “hemorrhagische cystitis”. Deze bloeding kan variëren van enkele rode bloedcellen in de urine (onzichtbaar voor het blote oog; alleen waarneembaar door de urine onder de microscoop te onderzoeken) tot een levensbedreigende bloeding uit de blaas. Als een bloeding uit de blaas wordt ontdekt terwijl een patiënt cyclofosfamide gebruikt, moet het medicijn worden gestopt totdat de blaas kan worden beoordeeld door middel van cystoscopie.
Onvruchtbaarheid
Cyclofosfamide kan onvruchtbaarheid veroorzaken bij zowel mannen als vrouwen die worden behandeld met het medicijn. Zoals bij veel van de bijwerkingen van cyclofosfamide het geval is, lijkt het risico van onvruchtbaarheid verband te houden met de duur van de behandeling (en waarschijnlijk ook met de cumulatieve dosis). De leeftijd van een vrouw kan ook van invloed zijn op het risico van onvruchtbaarheid, waarbij het optreden van vervroegde menopauze hoger is bij vrouwen die ouder zijn dan 30 jaar op het moment dat met de behandeling wordt begonnen.
In een langetermijnstudie naar de effectiviteit van cyclofosfamide bij de behandeling van lupus, was het risico van onvruchtbaarheid bij vrouwen die kinderen konden krijgen 57%.