 Het periodiek systeem is georganiseerd als een groot rooster. Elk element is op een specifieke plaats geplaatst vanwege zijn atomaire structuur. Zoals elk rooster heeft ook het periodiek systeem rijen (van links naar rechts) en kolommen (boven en onder). Elke rij en kolom heeft specifieke kenmerken. Zo zijn magnesium (Mg) en calcium (Mg) te vinden in kolom twee en hebben ze bepaalde overeenkomsten, terwijl kalium (K) en calcium (Ca) uit rij vier andere kenmerken hebben. Magnesium en natrium (Na) delen ook eigenschappen omdat ze in dezelfde periode zitten (vergelijkbare elektronenconfiguraties).
Het periodiek systeem is georganiseerd als een groot rooster. Elk element is op een specifieke plaats geplaatst vanwege zijn atomaire structuur. Zoals elk rooster heeft ook het periodiek systeem rijen (van links naar rechts) en kolommen (boven en onder). Elke rij en kolom heeft specifieke kenmerken. Zo zijn magnesium (Mg) en calcium (Mg) te vinden in kolom twee en hebben ze bepaalde overeenkomsten, terwijl kalium (K) en calcium (Ca) uit rij vier andere kenmerken hebben. Magnesium en natrium (Na) delen ook eigenschappen omdat ze in dezelfde periode zitten (vergelijkbare elektronenconfiguraties). 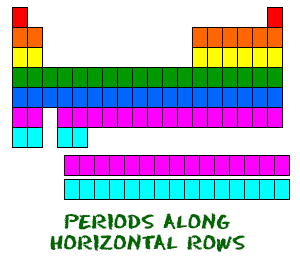 Ondanks dat er enkele vierkanten tussen zitten, lezen alle rijen van links naar rechts. Wanneer je naar het periodiek systeem kijkt, wordt elke rij een periode genoemd (snap je? zoals PERIODic table.). Alle elementen in een periode hebben hetzelfde aantal atomaire banen. Bijvoorbeeld, elk element in de bovenste rij (de eerste periode) heeft één baan voor zijn elektronen. Alle elementen in de tweede rij (de tweede periode) hebben twee banen voor hun elektronen. Naarmate je verder in de tabel komt, voegt elke rij een orbitaal toe. Op dit moment zijn er maximaal zeven elektronenbanen.
Ondanks dat er enkele vierkanten tussen zitten, lezen alle rijen van links naar rechts. Wanneer je naar het periodiek systeem kijkt, wordt elke rij een periode genoemd (snap je? zoals PERIODic table.). Alle elementen in een periode hebben hetzelfde aantal atomaire banen. Bijvoorbeeld, elk element in de bovenste rij (de eerste periode) heeft één baan voor zijn elektronen. Alle elementen in de tweede rij (de tweede periode) hebben twee banen voor hun elektronen. Naarmate je verder in de tabel komt, voegt elke rij een orbitaal toe. Op dit moment zijn er maximaal zeven elektronenbanen.
…en je groepen
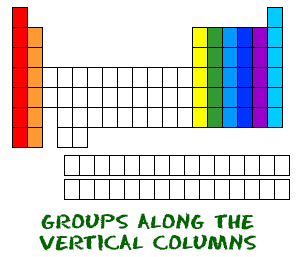 Nu weet je hoe periodes van links naar rechts lopen. Het periodiek systeem heeft ook een speciale naam voor zijn verticale kolommen. Elke kolom wordt een groep genoemd. De elementen in elke groep hebben hetzelfde aantal elektronen in de buitenste schil. Die buitenste elektronen worden ook valentie-elektronen genoemd. Het zijn de elektronen die betrokken zijn bij chemische bindingen met andere elementen.
Nu weet je hoe periodes van links naar rechts lopen. Het periodiek systeem heeft ook een speciale naam voor zijn verticale kolommen. Elke kolom wordt een groep genoemd. De elementen in elke groep hebben hetzelfde aantal elektronen in de buitenste schil. Die buitenste elektronen worden ook valentie-elektronen genoemd. Het zijn de elektronen die betrokken zijn bij chemische bindingen met andere elementen.
Elk element in de eerste kolom (groep een) heeft één elektron in zijn buitenste schil. Elk element in de tweede kolom (groep twee) heeft twee elektronen in de buitenste schil. Als je de kolommen blijft tellen, weet je hoeveel elektronen er in de buitenste schil zitten. Er zijn uitzonderingen op de volgorde als je naar de overgangselementen kijkt, maar je krijgt het algemene idee. Overgangselementen voegen elektronen toe aan de op één na laatste orbitaal. ijvoorbeeld, stikstof (N) heeft atoomnummer zeven. Het atoomnummer vertelt je dat er zeven elektronen in een neutraal stikstofatoom zitten. Hoeveel elektronen bevinden zich in zijn buitenste orbitaal? Stikstof staat in de vijftiende kolom, met het label ‘Groep VA’. De “V” is het Romeinse cijfer voor vijf en staat voor het aantal elektronen in de buitenste orbitaal. Al deze informatie vertelt je dat er twee elektronen in de eerste orbitaal zitten en vijf in de tweede (2-5).
Fosfor (P) zit ook in Groep VA, wat betekent dat het ook vijf elektronen in zijn buitenste orbitaal heeft. Maar omdat het atoomnummer van fosfor vijftien is, is de elektronenconfiguratie 2-8-5.
Twee aan de top
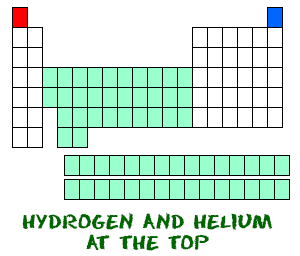 Waterstof (H) en helium (He) zijn bijzondere elementen. Waterstof, in zijn neutrale vorm, heeft geen neutron. Er is slechts één elektron en één proton. Je zult waarschijnlijk geen atomaire hydrogenen alleen rond zien zweven. Atoomwaterstof wil zich verbinden met andere elementen om zijn buitenste schil te vullen. In je scheikundewerk zal je waarschijnlijk moleculaire waterstof (H2) of waterstofionen (H+, protonen) gebruiken.
Waterstof (H) en helium (He) zijn bijzondere elementen. Waterstof, in zijn neutrale vorm, heeft geen neutron. Er is slechts één elektron en één proton. Je zult waarschijnlijk geen atomaire hydrogenen alleen rond zien zweven. Atoomwaterstof wil zich verbinden met andere elementen om zijn buitenste schil te vullen. In je scheikundewerk zal je waarschijnlijk moleculaire waterstof (H2) of waterstofionen (H+, protonen) gebruiken.
Helium (He) is anders dan alle andere elementen. Het is zeer stabiel met slechts twee elektronen in zijn buitenste baan (valentieschil). Hoewel het slechts twee elektronen heeft, wordt het toch ingedeeld bij de edelgassen, die acht elektronen in hun buitenste banen hebben. De edelgassen en helium zijn allemaal “gelukkig”, omdat hun valentieschil vol is.
Gerelateerde Video…
Wikipedia: Periodiek Systeem
Encyclopedia.com: Periodiek systeem