

Niels Bohr veranderde onze kijk op het atoom en op de wereld volledig. Hij realiseerde zich dat de klassieke fysica catastrofaal faalt wanneer dingen atoomgrootte of kleiner zijn, en hij herschiep het atoom zodat elektronen ‘toegestane’ banen rond de kern innamen, terwijl alle andere banen verboden waren. Daarmee stichtte hij de kwantummechanica.
Later, als vooraanstaand architect van de Kopenhagen interpretatie van de kwantummechanica, hielp hij ons begrip van hoe de natuur werkt op atomaire schaal opnieuw vorm te geven.
Begin
Niels Henrik David Bohr werd op 7 oktober 1885 geboren in de hoofdstad van Denemarken, Kopenhagen. Hij was het tweede van drie kinderen in een welvarend gezin uit de hogere klasse.
Zijn vader was Christian Bohr, een briljant professor in de fysiologie, die later tweemaal voor een Nobelprijs zou worden genomineerd. Zijn moeder was Ellen Adler, dochter van een rijke Deense politicus.
Zijn vader was opgevoed in een Luthers gezin en zijn moeder in een Joods gezin. Niels werd op zesjarige leeftijd als lutheraan gedoopt om een van zijn grootmoeders een plezier te doen. Noch zijn vader, noch zijn moeder praktiseerden hun religie.
Niels’ ouders waren zeer gepassioneerd over de opvoeding van hun kinderen. Niels kreeg thuis les totdat hij op 7-jarige leeftijd formeel onderwijs ging volgen aan de Gammelholm Grammar School. De school was zowel een lagere als een middelbare school. De school had een strenge discipline en verwachtte van de leerlingen dat ze hard werkten.
Zijn vader bracht verschillende collega-professoren van de Universiteit van Kopenhagen mee naar huis en de kinderen Bohr mochten luisteren naar de gesprekken, die veelomvattend waren en gingen over wetenschap, filosofie en de kunsten.
Fysieke en intellectuele kracht
Niels was goed in de meeste schoolvakken, maar was nogal zwak in zijn eigen moedertaal, het Deens. Hoewel hij graag praatte, had hij een grondige afkeer van het schrijven van opstellen. Van nature getalenteerd in wiskunde, werd hij steeds meer aangetrokken tot de wetenschappen.
Fysica interesseerde Niels in het bijzonder en tegen de tijd dat hij een tiener was, corrigeerde hij de fouten in de schoolboeken. Naast zijn intellectuele kracht was hij ook lichamelijk buitengewoon sterk. Hij corrigeerde niet alleen tekstboeken; hij ‘corrigeerde’ ook andere leerlingen en raakte betrokken bij gevechten op school, die hij meestal won.
Hoewel hij uiteindelijk een van ’s werelds grootste theoretische natuurkundigen zou worden, was hij ook praktisch getalenteerd met zijn handen. Hij en zijn jongere broer brachten uren door met het maken van dingen in de werkplaats van hun vader.
Zijn vader zag dat Niels de potentie had om een uitmuntende wetenschapper te worden. Geen van Niels’ ouders wilde echter dat hun zoon opgroeide met beperkte interesses. Ze zorgden ervoor dat hij cultureel en sportief goed onderlegd was.
Zijn vader was bijzonder enthousiast over het werk van de Duitse schrijver Goethe en droeg regelmatig grote delen van Faust aan zijn kinderen voor. Zijn vader hield ook van voetbal en moedigde zijn zoons aan om op school en de universiteit te spelen. Niels werd keeper, terwijl zijn jongere broer Harald voor Denemarken ging spelen en Olympisch zilver won.

Links: Christian Bohr. Rechts: (van links naar rechts): Moeder en kinderen. Alle drie de Bohr-kinderen studeerden af aan de Universiteit van Kopenhagen. Jenny werd lerares geschiedenis en Deens. Harald werd een beroemd wiskundige.
B.S. Degree and Some Remarkable Research Work
In 1903, 17 jaar oud, haalde Niels zijn diploma van de middelbare school. Later dat jaar begon hij zijn studie aan de Universiteit van Kopenhagen. Hij studeerde sterrenkunde, scheikunde, wiskunde en natuurkunde als hoofdvak.
In februari 1905, terwijl hij aan zijn graad werkte, kondigde de Koninklijke Deense Academie van Wetenschappen aan dat er een gouden medaille zou worden uitgereikt voor het beste onderzoeksartikel over methoden om de oppervlaktespanning van vloeistoffen te meten. Deze prijs was bedoeld voor ervaren wetenschappers, niet voor pas afgestudeerden. Niels was zich bewust van zijn eigen groeiende kracht in de natuurkunde en hij was ambitieus; hij besloot mee te doen aan de wedstrijd.
Hij had het geluk dat hij een professor als vader had. Zijn vader gaf hem ruimte in zijn fysiologisch laboratorium om experimenten te doen. Maandenlang werkte Niels alleen en obsessief ’s nachts. Hij maakte zijn eigen apparatuur en gebruikte die om waterstralen te vormen en metingen te verrichten.
Zijn vader, die de groeiende obsessie van zijn zoon voor de experimenten herkende, beval hem te stoppen en zijn onderzoek op te schrijven. Niels trok zich terug op het landgoed van zijn rijke grootouders van moeders kant om dit te doen. Het werkstuk dat hij eind oktober 1906 indiende, was zo briljant dat het hem een gouden medaille opleverde – een opmerkelijke prestatie voor een student. Hij deelde de prijs met Peder Pedersen, 11 jaar ouder, die spoedig professor in de elektrotechniek zou worden.
Niels Bohr studeerde in 1907 af met een B.S. graad.
M.S. en Ph.D.
In de jaren 1907 – 1911 voltooide Bohr zijn M.S. en Ph.D. graad in de natuurkunde. In beide gevallen richtte hij zijn aandacht op de elektronentheorie van metalen. Zijn Ph.D., in april 1911, was een zuiver theoretisch werk.
Fysica explodeert
Bohr kwam in de natuurkunde in een bijzonder spannende tijd.
- In 1897, toen Bohr 12 jaar oud was, ontdekte J.J. Thomson het elektron.
- In 1898 ontdekte Ernest Rutherford de door uranium uitgezonden alfa- en betadeeltjes.
- In 1905, toen Bohr aan zijn met een gouden medaille bekroonde onderzoek begon, ontketende Albert Einstein in zijn wonderjaar een spervuur van nieuwe ideeën en schreef vier wereldveranderende verhandelingen over: Brownse beweging, de gelijkwaardigheid van massa en energie, het foto-elektrisch effect, en speciale relativiteit.
- In 1909 ontdekte Ernest Rutherford de atoomkern.
Een slechte start bij J. J. Thomson
Bohr kreeg geld voor een jaar postdoctoraal werk in het buitenland en had het geluk als een van de uitverkorenen te worden toegelaten tot het Cavendish Laboratorium van J. J. Thomson aan de Universiteit van Cambridge in Engeland. Hij arriveerde in oktober 1911.
Bohr, toen 26 jaar oud, maakte een slechte start bij Thomson. Met een ongehoord gebrek aan subtiliteit was het eerste wat de jonge natuurkundige tegen de grote man zei: “Dit is fout” en hij wees naar een bladzijde van een boek van Thomson. Misschien had deze ongelukkige eerste ontmoeting er iets mee te maken, maar Bohr vond het moeilijk om vat te krijgen op het werk van het Cavendish Lab. Het onderzoek sprak hem niet aan.
Ernest Rutherford – Things are Looking Up
Tegen het einde van 1911 had Bohr een andere grote natuurkundige ontmoet, Ernest Rutherford, wiens laboratorium zich aan de Universiteit van Manchester bevond. Hij vroeg Rutherford of hij daarheen kon komen om met hem samen te werken. Rutherford zei ja, op voorwaarde dat Bohr eerst de goedkeuring van Thomson kreeg.
En zo nam Bohr in maart 1912 de trein naar Manchester om samen te werken met de man die hem zowel zou inspireren als een van zijn grootste vrienden zou worden.
Rutherford had in 1908 de Nobelprijs voor scheikunde gewonnen voor zijn werk op het gebied van radioactiviteit. In 1909 had hij de atoomkern ontdekt. Maar ondanks Rutherfords goede reputatie had zijn bewering dat het atoom bestond uit een minuscule, zeer dichte, positief geladen kern, omringd door negatief geladen elektronen, bij andere natuurkundigen op een lauwe weerklank gestuit.
Bohr raakte steeds meer geïnteresseerd in Rutherfords model van het atoom, met name in het gedrag van de elektronen, het onderwerp van zijn proefschrift.
Hij en Rutherford werden dikke vrienden en in de jaren die volgden brachten zij en hun echtgenotes gelukkige vakanties samen door. 25 jaar nadat ze voor het eerst hadden samengewerkt, zou Bohr samen met Rutherfords familie op de begrafenis van de grote man staan.
Grote Ideeën
Bohr keerde in de herfst van 1912 terug naar Denemarken met twee belangrijke ideeën:
Ten eerste wilde hij het gedrag van elektronen in het atoom begrijpen.
Ten tweede besloot hij zijn eigen gedrag als natuurkundige te modelleren naar dat van Rutherford. Bohr vond Rutherfords tomeloze energie, enthousiasme en kennis inspirerend. Ook de intellectueel opzwepende sfeer van de Rutherford groep vond hij zeer aangenaam. Hij hoopte ooit in Kopenhagen een even voortreffelijke onderzoeksgroep op te kunnen bouwen.
Niels Bohr’s Bijdragen aan de Wetenschap
Bohr verzekerde zich van werk als docent bij zijn terugkeer naar de Universiteit van Kopenhagen.
Terwijl richtte zijn theoretisch natuurkundig onderzoek zich op het begrijpen van de plaats van het elektron in het atoom.
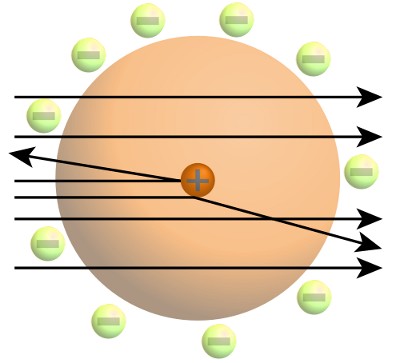
Uit het werk van Rutherford was gebleken dat atomen bestonden uit een minuscule, dichte, positief geladen kern. Het overgrote deel van het atoomvolume bestond uit lege ruimte die op de een of andere manier werd bewaakt door negatief geladen elektronen.
Bohr wist dat Rutherfords beeld van het atoom niet strookte met de wetten van de klassieke natuurkunde. Deze zeiden dat negatief geladen elektronen energie moeten uitstralen en naar de positief geladen kern getrokken moeten worden. Zelfs toen hij zijn proefschrift schreef, verklaarde Bohr dat het onmogelijk was voor de klassieke natuurkunde om gedrag op atomaire schaal te verklaren.
Nu keek hij naar de nieuwe kwantumfysica van Max Planck en Albert Einstein voor een oplossing voor het schijnbaar onmogelijke gedrag van elektronen. In feite begon hij in 1912 in Manchester op dit spoor.
De kwantumfysica had vastgesteld dat wanneer een voorwerp warmte of lichtgolven uitstraalt, de emissie niet in een ononderbroken stroom plaatsvindt, maar in afzonderlijke pakketten golfenergie.
Einstein noemde deze afzonderlijke pakketjes fotonen. Net als alle golven hebben fotonen een snelheid, een frequentie en een golflengte.
Planck leidde af dat de hoeveelheid energie die een foton met zich meedraagt, kan worden gevonden door slechts twee getallen te vermenigvuldigen. Dit waren de frequentie van het licht en een getal dat we nu de constante van Planck noemen. Zijn vergelijking luidde E = hf, waarbij E energie is, h de constante van Planck, en f de frequentie.
Het is duidelijk dat een foton slechts een hoeveelheid energie kon dragen die een veelvoud was van één getal – de constante van Planck. Alle andere energieën waren verboden. Dit was de essentie van de kwantumtheorie – licht mocht bepaalde hoeveelheden energie hebben, maar mocht geen andere hebben.
Hoe hard Bohr ook werkte, hoeveel literatuur hij ook las, en hoeveel hij het probleem ook besprak met collega’s, hij kon geen manier vinden om de kwantumtheorie – met andere woorden, toegestane toestanden en verboden toestanden – te betrekken op het gedrag van het elektron in het atoom.
Toen, in februari 1913, kwam de doorbraak. Hij hoorde over de Balmer-serie en de Balmer-formule.

Een deel van de Balmer-serie. Deze kleuren licht worden uitgezonden door waterstof bij hoge temperaturen. De golflengte en frequentie van de verschillende kleuren licht kunnen worden ingepast in een formule – de Balmerformule.
In 1885 was de Zwitserse wiskundige Johann Balmer op een wiskundige formule gestuit die de golflengten – en dus kleuren – voorspelde van het licht dat door hete waterstof werd uitgezonden. Er was geen theoretische basis voor de formule. Het werkte gewoon!
Nu had Bohr het gevoel dat hij echt iets op het spoor was. Hij nam Balmer’s formule en gebruikte de nieuwe quantum theorie om te laten zien waarom het werkte. Zo werd hij de vader van de kwantummechanica – de fysica van objecten op atomaire schaal.
Bohr stelde voor dat de relatie E = hf de kern vormde van de verklaring van het gedrag van elektronen. Net zoals lichtenergie werd geleverd in afzonderlijke pakketten energie, deden elektronen dat ook. Alleen bepaalde waarden van elektronenenergie waren toegestaan, en die konden voor waterstof worden berekend met de formule van Balmer.
In de formule van Balmer voegde Bohr de formule van Planck en enkele andere belangrijke getallen, waaronder de massa van het elektron, en zijn lading.
Het wiskundige resultaat was, simpel gezegd, een atoom dat kan worden voorgesteld als een piepklein zonnestelsel. Net zoals planeten om de zon draaien, draaien elektronen in vaste banen om de atoomkern. Hoe verder een elektron van de kern is, hoe hoger zijn energie. In tegenstelling tot planeten kunnen meer dan één elektron een baan om de atoomkern delen.
Bohr werpt nieuw licht op een oud probleem
Wetenschappers hebben zich lang afgevraagd hoe materie precies licht kon absorberen en uitzenden. Bohr’s nieuwe model van het atoom bood de verklaring.
Bohr zei dat elektronen beperkt zijn tot bepaalde cirkelvormige banen, maar van een lagere energiebaan naar een hogere energiebaan kunnen springen door licht te absorberen. Ze kunnen ook het omgekeerde doen en van een hogere energiebaan naar een lagere energiebaan vallen door licht uit te zenden – zoals te zien is in de afbeelding hieronder.
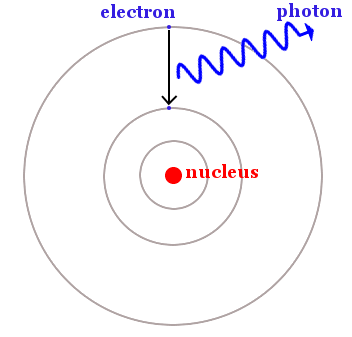
Een elektron valt van een hogere energiebaan naar een lagere energiebaan. De energie komt vrij in de vorm van een foton licht. Het verschil in energie tussen de banen is gelijk aan de energie van het foton, die kan worden berekend met de vergelijking van Planck, E = hf.
In de klassieke natuurkunde konden elektronen elke energie hebben. In de nieuwe kwantumfysica werden elektronen beperkt tot gedefinieerde banen met een vaste energie.
Wanneer een elektron energie opnam, maakte het een kwantumsprong, waarbij het uit een baan verdween en in een hogere verscheen, dwars door een verboden energiezone. Wanneer een elektron energie verloor, verdween het uit een hogere energiebaan en verscheen het in een lagere energiebaan, gescheiden door een verboden zone.
De kwantumtheorie ‘verklaarde’ waarom elektronen hun energie niet wegstralen wanneer zij in de kern vallen, omdat dit proces verboden is: de kern is geen toegestane energiebaan voor een elektron.
De kwantumtheorie verklaarde ook de spectra van atomen, door te laten zien dat de intense kleuren in spectra verband hielden met de energieën van elektronenbanen in atomen.

Het emissiespectrum van helium. De intense lijnen onthullen de energieën van de toegestane elektronenbanen in helium.
De grondlegging van de kwantumchemie
Bohr toonde aan dat de chemische eigenschappen van de elementen voornamelijk voortvloeien uit het gedrag van elektronen die de hoogste stabiele baan bezetten – deze worden de valentie-elektronen genoemd. Daarmee verklaarde hij een groot deel van de structuur van het periodiek systeem en stichtte hij een nieuwe wetenschappelijke discipline – de kwantumchemie.
Bohr duwt ons begrip van het atoom vooruit met een kwantumsprong
In 1912 hadden veel wetenschappers het model van Rutherford nog niet eens overgenomen. In 1913 combineerde Bohr wiskunde met zijn krachtige natuurkundige intuïtie om vast te stellen dat elektronen in welbepaalde banen om de atoomkern draaien. Het Rutherford-Bohr model van het atoom wordt nog steeds onderwezen op middelbare scholen.
Bohr opende het atoom voor de kwantumtheorie: het was een object dat zijn toestand in stappen veranderde in plaats van vloeiend.
Hoewel zijn theorie alleen goed werkte voor atomen met één elektron – met andere woorden waterstof of geïoniseerd helium. Toch was die van Bohr de cruciale stap – hij opende de deur. Al snel stond de kwantumwereld bol van ijverige natuurkundigen die gretig de bizarre hoekjes en gaatjes onderzochten.
 “Het hele werkterrein is inderdaad van een zeer eenzame toestand plotseling veranderd in een wanhopig druk gebied waar bijna iedereen hard aan het werk lijkt te zijn.”
“Het hele werkterrein is inderdaad van een zeer eenzame toestand plotseling veranderd in een wanhopig druk gebied waar bijna iedereen hard aan het werk lijkt te zijn.”
In de jaren twintig van de vorige eeuw gaven Werner Heisenberg en Erwin Schrödinger een sterk verbeterd kwantumbeeld van de plaats van het elektron in het atoom.
Bohr in trek
Bohr publiceerde in 1913 drie beroemde quantum-publicaties. Daarmee maakte zijn reputatie als natuurkundige zijn eigen quantumsprong. Hij gaf seminars aan de Universiteit van Göttingen in Duitsland – het centrum van het wiskundige universum – en accepteerde een aanbod van Ernest Rutherford om terug te keren naar Manchester in een hoge academische onderzoeksfunctie.
Het uitbreken van de Eerste Wereldoorlog bemoeilijkte de zaken, maar Bohr werkte van 1914 – 1916 in Manchester.
Hij keerde daarna terug naar Kopenhagen om daar de eerste leerstoel voor theoretische fysica van de universiteit te bekleden. Hij zamelde geld in om een onderzoeksinstituut voor theoretische fysica op te richten als onderdeel van de universiteit, naar het voorbeeld van de onderzoeksgroep van Rutherford. Werner Heisenberg en verschillende andere architecten van de nieuwe kwantummechanica ontwikkelden hun ideeën in Kopenhagen onder leiding van Bohr.
Heden ten dage is het Niels Bohr Instituut nog steeds actief in de voorste gelederen van de natuurwetenschappen.
Nobelprijs
Bohr kreeg in 1922 de Nobelprijs voor Natuurkunde voor het werk dat hij in 1913 verrichtte.
De Kopenhagense interpretatie van de kwantummechanica
Tijdens de ontwikkeling van de kwantummechanica ontstonden er verschillende opvattingen over hoe deze geïnterpreteerd moest worden. Er was een groot intellectueel geschil (altijd eerder goedmoedig dan verbitterd) tussen Einstein en Bohr over de vraag of, om Einstein te parafraseren, God dobbelt met het heelal. Einstein zei nee, Bohr zei ja.

Bohr en Einstein genoten van elkaars gezelschap en waren het over veel dingen eens, maar over de kwantumwereld konden ze het niet eens worden.
Heden ten dage accepteert de overgrote meerderheid van de natuurkundigen Bohrs stelling dat God inderdaad dobbelt met het universum.
Op atomaire schaal kan de wereld er vreemd uitzien voor iedereen die haar hoopt te interpreteren volgens de wetten van het ‘gezond verstand’ of zelfs de regels van de klassieke natuurkunde. Het is een wereld waarin iets wat we normaal als een golf beschouwen, zoals licht, zich als een deeltje kan gedragen. Of iets wat we normaal als een deeltje beschouwen, zoals een elektron, zich als een golf kan gedragen. Een enkel neutron kan zich op twee plaatsen tegelijk bevinden, wel enkele centimeters uit elkaar. Het is een wereld waarin een kat tegelijkertijd als levend en dood (of in een tussenliggende toestand) kan worden beschouwd.
Drie van de reuzen van de twintigste-eeuwse natuurkunde – Niels Bohr, Werner Heisenberg en Wolfgang Pauli – waren de hoofdrolspelers bij de ontwikkeling van wat bekend is geworden als de Kopenhagen interpretatie van de kwantum mechanica. Pauli moest bemiddelen tussen Bohr en Heisenberg (die in Bohrs instituut werkte) omdat ze het soms zo oneens waren over hoe de kwantumwereld moest worden geïnterpreteerd dat ze nauwelijks met elkaar konden praten.
Uit deze verzengende intellectuele smeltkroes kwamen vier van de belangrijkste ideeën naar voren van wat bekend is geworden als de Kopenhagen interpretatie van de kwantumtheorie. Dit waren:
- Bohrs complementariteitsprincipe/Heisenbergs onzekerheidsprincipe
- Golf-deeltje dualiteit
- Interpretatie van golf-functies met behulp van waarschijnlijkheden
- Het correspondentieprincipe – de versmelting van kwantummechanica met klassieke mechanica bij grotere kwantumgetallen
Wat de filosofische implicaties van de Kopenhagen interpretatie ook mogen zijn – en die zijn er genoeg – bijvoorbeeld dat de werkelijkheid niet bestaat tenzij je ernaar zoekt – wat we zeker weten is dat de methoden van de kwantummechanica in de praktijk werken.
De kwantummechanica is het krachtigste instrument dat we ooit hebben gehad om uit te zoeken hoe het heelal op atomaire schaal werkt.
De samengestelde kern
Toen James Chadwicks ontdekking van het neutron in Rutherfords laboratorium in 1932, richtte Bohr zijn aandacht op de atoomkern.
Nucleaire reacties fascineerden hem, vooral reacties waarbij atoomkernen met neutronen werden bestookt om nieuwe, radioactieve kernen te vormen – neutronenvangstreacties.
Ontevreden met de pogingen van andere natuurkundigen om neutronenvangst te verklaren, formuleerde Bohr in 1934 en 1935 de samengestelde-kerntheorie, die hij in 1936 publiceerde. Zijn idee was dat wanneer een neutron een kern binnenkomt, het herhaaldelijk botst met een groot aantal bestaande neutronen en protonen, en niet slechts met één van hen. Het resultaat is een semi-stabiele samengestelde kern. Deze kern verkeert door de botsingen in een hoogenergetische toestand en verliest deze energie op verschillende manieren, zoals door het verliezen van een neutron of het uitzenden van gammastralen.
Bohrs theorie stond de volgende twee decennia centraal, totdat in de jaren vijftig zijn zoon Aage een sleutelrol speelde bij het formuleren van een verbeterd model van de kern en kernreacties.
De kern als vloeistofdruppel
In 1939 werkten Niels Bohr en John Archibald Wheeler samen aan het vloeistofdruppel-model. In dit model wordt de kern voorgesteld als een draaiende druppel van een onsamendrukbare vloeistof die bijeen wordt gehouden door oppervlaktespanning.
Een vloeistofdruppel kan van zijn bolvorm worden vervormd en een grote vloeistofdruppel kan uiteenvallen in twee nieuwe druppels. Op dezelfde manier kan een grote atoomkern, zoals uranium, uiteenvallen tot twee nieuwe atoomkernen – dit is kernsplijting, de energiebron achter zowel de uraniumatoombom als de uraniumcentrale.

De kleine atoomkern werd gemodelleerd als een druppel vloeistof die door oppervlaktespanning bij elkaar wordt gehouden. Net als een vloeistof was de druppel bolvormig, maar kon hij van deze vorm worden vervormd.
Het vloeistofdruppelmodel had zijn grootste successen bij het verklaren van de eigenschappen van zware kernen, zoals uranium.
Het Manhattan Project
In april 1940 werd Denemarken binnengevallen door de strijdkrachten van nazi-Duitsland. Bohr’s moeder was Joods, wat betekende dat hij problemen kon krijgen. In het begin waren die er gelukkig niet.
In september 1943 besloten de nazi’s de Deense joden naar concentratiekampen te deporteren. Bohr kreeg een tip dat de nazi’s van plan waren hem te arresteren. Het gezin Bohr vluchtte in vissersbootjes over de korte strook water die Denemarken van Zweden scheidde. Zweden was officieel neutraal en was niet binnengevallen door de nazi’s. Bijna alle 7000 Deense joden vluchtten in 1943 over zee naar Zweden.
In oktober 1943, een week na elkaar, vlogen Niels en zijn zoon Aage vanuit Zweden over het door de nazi’s bezette Noorwegen naar het Verenigd Koninkrijk. Ze vlogen in de bommenruimten van Britse oorlogsvliegtuigen die naar Zweden kwamen om hen op te halen. Margrethe Bohr bleef tot het einde van de oorlog in Zweden.

Op 58-jarige leeftijd werd Niels Bohr vanuit Zweden hoog over het door de nazi’s bezette Noorwegen en de Noordzee naar Schotland gevlogen in een de Havilland Mosquito. Tijdens de vlucht lag hij op de plaats waar normaal gesproken de bommen van het vliegtuig zouden worden geplaatst. Zijn zuurstoftoevoer viel tijdens de vlucht uit en hij verloor het bewustzijn. Nadat de piloot de communicatie met Bohr had verloren, raadde hij wat er was gebeurd en bracht het toestel naar een lagere hoogte. Tegen de tijd dat ze landden was Bohr weer bij bewustzijn.
Eenmaal veilig in Groot-Brittannië begonnen vader en zoon met wetenschappelijk onderzoek voor de Britse regering, waar ze werkten in het atoombomproject onder leiding van James Chadwick.
In 1944 raakten vader en zoon betrokken bij het Manhattan Project, waarbij zij zowel in de Verenigde Staten als in Londen aanzienlijke hoeveelheden tijd doorbrachten. Om hun aanwezigheid in Amerika geheim te houden, reisden zij onder de namen “Nicholas Baker” en “James Baker.”
Enkele persoonlijke details en het einde
In 1912 trouwde Bohr in Kopenhagen met Margrethe Nørlund. Zij kregen zes zonen, van wie er een, Aage Bohr, zijn vader zou evenaren door het winnen van de Nobelprijs voor Natuurkunde.
Niels Bohr stierf op 77-jarige leeftijd aan een plotseling hartfalen in zijn huis in Kopenhagen op 18 november 1962. Zijn as werd begraven op het Assistens kerkhof in Kopenhagen, bij de graven van zijn ouders en zijn broer Harald. Ook Margrethe’s as werd daar begraven toen zij overleed.
Auteur van deze pagina: The Doc
Foto’s digitaal verbeterd en ingekleurd door deze website. © Alle rechten voorbehouden.
Citeer deze pagina
Gebruik de volgende MLA-conforme citatie:
"Niels Bohr." Famous Scientists. famousscientists.org. 19 Dec. 2015. Web. <www.famousscientists.org/niels-bohr/>.
Gepubliceerd door FamousScientists.org
Verder Lezen
A. P. French, P. J. Kennedy
Niels Bohr: A Centenary Volume
Harvard University Press, 1987
Abraham Pais
Niels Bohr’s Times: In Physics, Philosophy, and Polity
Clarendon Press, 1993
Ray Spangenburg, Diane Kit Moser
Niels Bohr, Revised Edition
Infobase Publishing, 1 jan 2009
Richard Rhodes
The Making of the Atomic Bomb
Simon and Schuster, 2012
J.R. Nielsen
Niels Bohr Collected Works: Volume 1 Vroegste werk (1905 – 1911)
Elsevier, 2013