 Układ okresowy jest zorganizowany jak duża siatka. Każdy pierwiastek jest umieszczony w określonym miejscu ze względu na jego strukturę atomową. Jak każda siatka, układ okresowy ma wiersze (od lewej do prawej) i kolumny (w górę i w dół). Każdy rząd i kolumna mają określone właściwości. Na przykład magnez (Mg) i wapń (Mg) znajdują się w kolumnie drugiej i mają pewne podobieństwa, podczas gdy potas (K) i wapń (Ca) z rzędu czwartego mają inne cechy. Magnez i sód (Na) również mają wspólne cechy, ponieważ znajdują się w tym samym okresie (podobne konfiguracje elektronowe).
Układ okresowy jest zorganizowany jak duża siatka. Każdy pierwiastek jest umieszczony w określonym miejscu ze względu na jego strukturę atomową. Jak każda siatka, układ okresowy ma wiersze (od lewej do prawej) i kolumny (w górę i w dół). Każdy rząd i kolumna mają określone właściwości. Na przykład magnez (Mg) i wapń (Mg) znajdują się w kolumnie drugiej i mają pewne podobieństwa, podczas gdy potas (K) i wapń (Ca) z rzędu czwartego mają inne cechy. Magnez i sód (Na) również mają wspólne cechy, ponieważ znajdują się w tym samym okresie (podobne konfiguracje elektronowe). 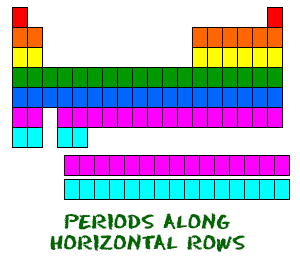 Mimo, że pomijają niektóre kwadraty pomiędzy nimi, wszystkie rzędy czytamy od lewej do prawej. Kiedy patrzysz na układ okresowy, każdy rząd jest nazywany okresem (rozumiesz? jak układ okresowy). Wszystkie pierwiastki w danym okresie mają taką samą liczbę orbitali atomowych. Na przykład, każdy pierwiastek w górnym rzędzie (pierwszy okres) ma jeden orbital dla swoich elektronów. Wszystkie pierwiastki w drugim rzędzie (drugi okres) mają dwa orbitale dla swoich elektronów. W miarę przesuwania się w dół tabeli, każdy rząd dodaje jeden orbital. W tym czasie istnieje maksymalnie siedem orbitali elektronowych.
Mimo, że pomijają niektóre kwadraty pomiędzy nimi, wszystkie rzędy czytamy od lewej do prawej. Kiedy patrzysz na układ okresowy, każdy rząd jest nazywany okresem (rozumiesz? jak układ okresowy). Wszystkie pierwiastki w danym okresie mają taką samą liczbę orbitali atomowych. Na przykład, każdy pierwiastek w górnym rzędzie (pierwszy okres) ma jeden orbital dla swoich elektronów. Wszystkie pierwiastki w drugim rzędzie (drugi okres) mają dwa orbitale dla swoich elektronów. W miarę przesuwania się w dół tabeli, każdy rząd dodaje jeden orbital. W tym czasie istnieje maksymalnie siedem orbitali elektronowych.
…i Twoje grupy
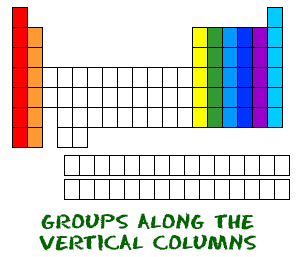 Teraz wiesz już o okresach od lewej do prawej. Układ okresowy ma również specjalną nazwę dla swoich pionowych kolumn. Każda kolumna nazywana jest grupą. Pierwiastki w każdej grupie mają taką samą liczbę elektronów na orbitalach zewnętrznych. Te zewnętrzne elektrony są również nazywane elektronami walencyjnymi. Są to elektrony uczestniczące w wiązaniach chemicznych z innymi pierwiastkami.
Teraz wiesz już o okresach od lewej do prawej. Układ okresowy ma również specjalną nazwę dla swoich pionowych kolumn. Każda kolumna nazywana jest grupą. Pierwiastki w każdej grupie mają taką samą liczbę elektronów na orbitalach zewnętrznych. Te zewnętrzne elektrony są również nazywane elektronami walencyjnymi. Są to elektrony uczestniczące w wiązaniach chemicznych z innymi pierwiastkami.
Każdy pierwiastek w pierwszej kolumnie (grupa pierwsza) ma jeden elektron w swojej zewnętrznej powłoce. Każdy pierwiastek w drugiej kolumnie (grupa druga) ma dwa elektrony w powłoce zewnętrznej. Licząc kolejne kolumny, będziesz wiedział, ile elektronów znajduje się w zewnętrznej powłoce. Istnieją wyjątki od tej kolejności, gdy patrzysz na pierwiastki przejściowe, ale rozumiesz ogólną ideę. Pierwiastki przejściowe dodają elektrony do przedostatniego orbitalu.
Na przykład azot (N) ma liczbę atomową siedem. Liczba atomowa mówi, że istnieje siedem elektronów w neutralnym atomie azotu. Ile elektronów znajduje się na jego zewnętrznym orbitalu? Azot znajduje się w piętnastej kolumnie, oznaczonej jako „Grupa VA”. V” jest rzymską cyfrą oznaczającą pięć i reprezentuje liczbę elektronów na zewnętrznym orbitalu. Wszystkie te informacje mówią, że na pierwszym orbitalu znajdują się dwa elektrony, a na drugim pięć (2-5).
Fosfor (P) jest również w grupie VA, co oznacza, że również ma pięć elektronów w swoim zewnętrznym orbitalu. Jednak, ponieważ liczba atomowa fosforu wynosi piętnaście, konfiguracja elektronowa to 2-8-5.
Dwa na szczycie
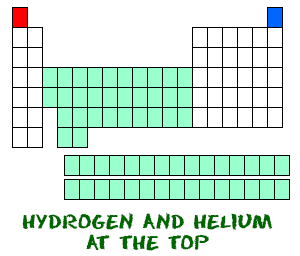 Wodór (H) i hel (He) są pierwiastkami szczególnymi. Wodór, w swojej neutralnej postaci, nie posiada neutronu. Jest tylko jeden elektron i jeden proton. Prawdopodobnie nie znajdziesz wodoru atomowego, który unosiłby się w powietrzu sam. Wodór atomowy chce łączyć się z innymi pierwiastkami, aby wypełnić swoją zewnętrzną powłokę. Twoja praca z chemii będzie najprawdopodobniej wykorzystywać wodór cząsteczkowy (H2) lub jony wodorowe (H+, protony).
Wodór (H) i hel (He) są pierwiastkami szczególnymi. Wodór, w swojej neutralnej postaci, nie posiada neutronu. Jest tylko jeden elektron i jeden proton. Prawdopodobnie nie znajdziesz wodoru atomowego, który unosiłby się w powietrzu sam. Wodór atomowy chce łączyć się z innymi pierwiastkami, aby wypełnić swoją zewnętrzną powłokę. Twoja praca z chemii będzie najprawdopodobniej wykorzystywać wodór cząsteczkowy (H2) lub jony wodorowe (H+, protony).
Hel (He) różni się od wszystkich innych pierwiastków. Jest bardzo stabilny, posiada tylko dwa elektrony na zewnętrznych orbitalach (powłoka walencyjna). Nawet jeśli ma tylko dwa elektrony, jest nadal zgrupowany z gazów szlachetnych, które mają osiem elektronów w ich skrajnych orbitali. Gazy szlachetne i hel są wszystkie „szczęśliwe”, ponieważ ich powłoka walencyjna jest pełna.
Powiązane filmy…
Wikipedia: Układ okresowy
Encyklopedia.com: Układ okresowy