 A tabela periódica está organizada como uma grande grelha. Cada elemento é colocado num local específico devido à sua estrutura atómica. Como em qualquer grelha, a tabela periódica tem linhas (da esquerda para a direita) e colunas (para cima e para baixo). Cada linha e coluna tem características específicas. Por exemplo, o magnésio (Mg) e o cálcio (Mg) encontram-se na coluna dois e partilham certas semelhanças enquanto o potássio (K) e o cálcio (Ca) da linha quatro partilham características diferentes. O magnésio e o sódio (Na) também partilham qualidades porque se encontram no mesmo período (configurações electrónicas semelhantes).
A tabela periódica está organizada como uma grande grelha. Cada elemento é colocado num local específico devido à sua estrutura atómica. Como em qualquer grelha, a tabela periódica tem linhas (da esquerda para a direita) e colunas (para cima e para baixo). Cada linha e coluna tem características específicas. Por exemplo, o magnésio (Mg) e o cálcio (Mg) encontram-se na coluna dois e partilham certas semelhanças enquanto o potássio (K) e o cálcio (Ca) da linha quatro partilham características diferentes. O magnésio e o sódio (Na) também partilham qualidades porque se encontram no mesmo período (configurações electrónicas semelhantes). 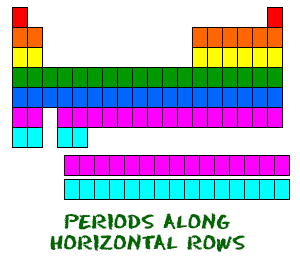 Even, embora saltem alguns quadrados no meio, todas as linhas são lidas da esquerda para a direita. Quando se olha para a tabela periódica, cada linha é chamada período (Get it? Like PERIODic table.). Todos os elementos de um período têm o mesmo número de orbitais atómicos. Por exemplo, cada elemento da linha superior (o primeiro período) tem um orbital para os seus electrões. Todos os elementos da segunda fila (o segundo período) têm dois orbitais para os seus electrões. À medida que se desce a tabela, cada linha adiciona um orbital. Neste momento, há um máximo de sete orbitais de electrões.
Even, embora saltem alguns quadrados no meio, todas as linhas são lidas da esquerda para a direita. Quando se olha para a tabela periódica, cada linha é chamada período (Get it? Like PERIODic table.). Todos os elementos de um período têm o mesmo número de orbitais atómicos. Por exemplo, cada elemento da linha superior (o primeiro período) tem um orbital para os seus electrões. Todos os elementos da segunda fila (o segundo período) têm dois orbitais para os seus electrões. À medida que se desce a tabela, cada linha adiciona um orbital. Neste momento, há um máximo de sete orbitais de electrões.
…e os Seus Grupos
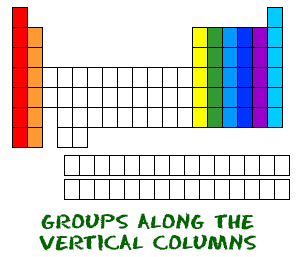 Agora conhece os períodos que vão da esquerda para a direita. A tabela periódica tem também um nome especial para as suas colunas verticais. Cada coluna é chamada um grupo. Os elementos de cada grupo têm o mesmo número de electrões no orbital exterior. Esses electrões exteriores são também chamados de electrões de valência. São os electrões envolvidos em ligações químicas com outros elementos.
Agora conhece os períodos que vão da esquerda para a direita. A tabela periódica tem também um nome especial para as suas colunas verticais. Cada coluna é chamada um grupo. Os elementos de cada grupo têm o mesmo número de electrões no orbital exterior. Esses electrões exteriores são também chamados de electrões de valência. São os electrões envolvidos em ligações químicas com outros elementos.
Todos os elementos da primeira coluna (grupo um) têm um electrão no seu invólucro exterior. Cada elemento da segunda coluna (grupo dois) tem dois electrões na sua concha exterior. Ao continuar a contar as colunas, saberá quantos electrões estão na carapaça exterior. Há excepções à ordem quando se olha para os elementos de transição, mas obtém-se a ideia geral. Os elementos de transição acrescentam electrões ao penúltimo orbital.
Por exemplo, o azoto (N) tem o número atómico sete. O número atómico indica que existem sete electrões num átomo neutro de azoto. Quantos electrões existem no seu orbital exterior? O nitrogénio está na décima quinta coluna, rotulado “Grupo VA”. O ‘V’ é o numeral romano para cinco e representa o número de electrões no orbital exterior. Toda esta informação diz-lhe que existem dois electrões no primeiro orbital e cinco no segundo (2-5).
Phosphorus (P) também está no Grupo VA, o que significa que também tem cinco electrões no seu orbital exterior. Contudo, como o número atómico para o fósforo é quinze, a configuração dos electrões é 2-8-5.
h2>Dois no topo 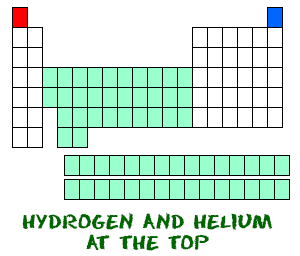 Hidrogénio (H) e hélio (He) são elementos especiais. O hidrogénio, na sua forma neutra, não tem um neutron. Existe apenas um electrão e um protão. Provavelmente não encontrará hidrogénios atómicos a flutuar por si mesmos. O hidrogénio atómico quer combinar-se com outros elementos para preencher a sua casca exterior. O seu trabalho de química irá mais gostar de utilizar hidrogénio molecular (H2) ou iões de hidrogénio (H+, prótons).
Hidrogénio (H) e hélio (He) são elementos especiais. O hidrogénio, na sua forma neutra, não tem um neutron. Existe apenas um electrão e um protão. Provavelmente não encontrará hidrogénios atómicos a flutuar por si mesmos. O hidrogénio atómico quer combinar-se com outros elementos para preencher a sua casca exterior. O seu trabalho de química irá mais gostar de utilizar hidrogénio molecular (H2) ou iões de hidrogénio (H+, prótons).
Helium (He) é diferente de todos os outros elementos. É muito estável com apenas dois electrões na sua esfera orbital externa (concha de valência). Apesar de ter apenas dois electrões, ainda está agrupado com os gases nobres que têm oito electrões nas suas orbitais mais exteriores. Os gases nobres e o hélio são todos “felizes”, porque a sua concha de valência está cheia.
Vídeo relacionado…
div> Encyclopædia Britannica: Tabela Periódica
Wikipedia: Tabela Periódica
Enciclopédia.com: Tabela Periódica