INTRODUÇÃO
Vírus são agentes patogénicos que são especialmente problemáticos nos receptores de transplantes, uma vez que a questão das infecções virais nos transplantes reflecte um equilíbrio complexo entre as várias infecções virais que um paciente pode ter ao longo da sua vida, a resposta imunitária antiviral do receptor, e o nível de imunossupressão necessário para assegurar um enxerto funcional.
Infecção por poliomavírus BK (BKV) é um problema emergente nos transplantes renais, e é considerado o preço pago pela imunossupressão moderna e potente (IS).
ASPECTOSBIOLÓGICOS DO VÍRUS
O poliomavírus, juntamente com o papilomavírus, pertence à família dos papovavírus patogénicos. O vírus BK (BKV) pertence à família dos poliomavírus, juntamente com outros poliomavírus que foram detectados em humanos, tais como o vírus JC (JCV), o vírus KI, o vírus WU, o vírus do carcinoma celular Merkel, e o vírus Simian 40 (SV40).
Estes são vírus pequenos, não desenvolvidos, com um diâmetro de 42 nm. O capsid tem simetria icosaédrica e abriga um genoma de cadeia circular dupla de ADN com mais de 5000 pares de bases, composto por uma região “precoce” altamente conservada e códigos para o “antigénio T/t” (TAg), que está implicado na transformação, replicação viral, e regulação e expressão genética; e uma região “tardia” que codifica as três proteínas capsidiais, conhecidas como VP1, VP2, e VP3, e para uma proteína chamada “agnoproteína”, uma região reguladora não codificadora situada entre as outras duas, onde estão localizados os determinantes para a replicação, a união TAg, e os elementos de regulação transcripcional.
O poliomavírus possui especificidade de adaptação ao seu hospedeiro; por conseguinte, a sua evolução está provavelmente associada à evolução da espécie hospedeira, pelo que a infecção natural ocorre apenas num número limitado de espécies estreitamente relacionadas, constituindo um marcador para estabelecer as diferenças raciais entre os seres humanos.
Utilizando a análise de sequência de genes, foram estabelecidos diferentes genótipos: europeus, asiáticos e africanos. Os restantes genótipos correspondem a recombinações destes três, e embora a sua origem seja difícil de estabelecer, o estudo deste vírus poderia fornecer uma ferramenta para ajudar a compreender a evolução das migrações humanas.
BKV está associado a duas complicações observadas nos receptores de transplantes: A nefropatia associada ao vírus BK (BKVN) nos transplantes renais, e a cistite hemorrágica nos transplantes de medula óssea. Em contraste com o BKV, embora o JCV resida no uroepitélio e normalmente reactive, raramente produz nefropatia, mas está associado a leucoencefalopatia multifocal e encefalite. A SV40, que vem de símios, foi introduzida na população humana através de vacinas contaminadas com poliomielite e adenovírus, e embora a sua presença tenha sido detectada em biópsias renais transplantadas, a sua importância no transplante renal ainda não está bem definida.
EPIDEMIOLOGIA E FACTORES DE RISCO
A infecção primária ocorre subclinicamente durante a primeira década de vida, com uma seroprevalência superior a 80% na população adulta.
A fonte da infecção é exclusivamente humana, não foi demonstrado que os animais actuem como reservatórios, e a via de transmissão pode ser fecal-oral, respiratória, transplacentária, e através de tecidos doados. Durante a fase virémica, o vírus infecta os tecidos, urotelium, tecido linfático e cérebro, produzindo uma infecção lítica latente.
Após a transmissão viral natural durante a infância, o BKV permanece no tracto urinário com reactivações intermitentes e baixos níveis de virúria (Vr), 5%-10% em adultos imunocompetentes.1,2 Em indivíduos imunocomprometidos, a frequência de BK Vr aumenta para 20%-60%, e níveis ainda maiores de virúria e o aparecimento de células de engodo na urina também são frequentes.3
No transplante renal, a prevalência de nefropatias associadas ao vírus BK (BKVN) oscila entre 1% e 10%,4 com base mais no tratamento imunossupressor e métodos de diagnóstico do que devido a diferenças epidemiológicas reais.
Em 2004, o tratamento da infecção pelo BKVN após transplante renal foi incluído na base de dados americana como variável de evolução pós-transplante (TBKV); os dados foram posteriormente analisados, resultando num total de >48 000 transplantes, 1474 dos quais foram tratados no prazo de 24 meses. A incidência acumulada de TBKV aumentou com o tempo, passando de 3,45% aos 24 meses para 6,6% aos 60 meses após o transplante.
A falha do enxerto secundária ao BKVN ocorre a uma taxa de 50%-100% aos 24 meses em centros sem programas de rastreio, o que salienta a importância de um diagnóstico precoce da doença.5
Diferentes protocolos IS foram identificados como factores de risco para o desenvolvimento de BKVN, especialmente o uso de terapias triplas com medicamentos anticalcineurínicos, micofenolato mofetil (MMF), e esteróides,5,6 mas também foram descritos casos de BKVN quando se utilizam outros regimes IS, o que indica que a intensidade do tratamento IS, e não o medicamento específico em si, é o factor de risco neste caso. Existem também outros tipos de factores de risco, tais como factores do paciente (homens >50 anos de idade, receptor seronegativo BKV), factores de enxerto (doador seropositivo BKV, incompatibilidades HLA, lesão imunológica ou isquémica), e factores virais (carga viral latente, serotipo capsid, e capacidade de replicação).7
BKVN DIAGNÓSTICO HISTOLOGICO E PROGRESSÃO
Células decoy, virúria e viremia apenas indicam replicação viral, não nefropatia, mas são ferramentas chave para a prevenção e monitorização da doença.
O único sinal clínico de BKVN é a deterioração da função renal, e quando isto ocorre, já é demasiado tarde para intervir, uma vez que os danos renais já foram produzidos.
O diagnóstico da doença só pode ser realizado com uma biopsia de enxerto em que as típicas inclusões virais nucleares basofílicas são encontradas nas células epiteliais (tubulares, cápsula de Bowman, e/ou urotelial), e sinais de inflamação com tubulite (Figura 1A), achados semelhantes aos que aparecem na rejeição aguda de transplante por células T. Só utilizando a técnica imunohistoquímica para o SV-40 LTAg podemos observar uma coloração nuclear positiva e identificar o poliomavírus (BK, JC) como o responsável pela inflamação, descartando assim o diagnóstico de rejeição aguda das células T (Figura 1B) e confirmando o diagnóstico de BKVN.
BKVN as lesões histológicas são focais e heterogéneas, pelo que uma biópsia negativa não pode excluir o diagnóstico. Como tal, este teste deve ser repetido se a carga viral no sangue do paciente permanecer persistentemente elevada.
Os padrões histológicos de BKVN2,8,9 baseiam-se na identificação e extensão do infiltrado inflamatório e da fibrose associada à infecção viral, o que permite estabelecer três padrões histológicos (Figura 2).
EVOLUÇÃO CLÍNICA E OPORTUNIDADES DE PREVENÇÃO E DIAGNÓSTICO A evolução clínica comum de BKVN9 está representada na Figura 3, que mostra como o desenvolvimento da doença é previsto pelo aparecimento da virúria BK (BK Vr), uma consequência da reactivação e replicação viral no tracto urinário, com o aparecimento de células típicas de engodo (figura 4), que são fáceis de identificar utilizando testes citológicos de rotina da urina. Contudo, a quantificação de Vr utilizando técnicas de PCR é mais sensível do que a utilização de citologia, e permite distinguir entre infecções por BKV e JCV.
Quando a virúria é >105 cópias/ml e persiste, é seguida semanas ou meses depois pelo desenvolvimento de viremia (Vm) a >107 cópias/ml e, finalmente, de BKVN. BK Vr não é um diagnóstico de dano parenquimatoso renal, mas o aparecimento simultâneo de Vm e Vr é patognomónico de dano parenquimatoso renal (BKVN). Manter, ou mais típico, o aumento da Vm é um factor preditivo da deterioração da função renal, e está correlacionado com a presença e gravidade das lesões histológicas. Em doentes com função renal normal ou moderadamente baixa, a probabilidade de encontrar indicadores histológicos de BKVN é directamente proporcional à duração e severidade da viremia. A viremia elevada e sustentada identifica os doentes com replicação viral descontrolada que leva a lesões renais.
Em conclusão, o diagnóstico precoce e a intervenção minimizam os danos no transplante. A figura 5 demonstra um algoritmo de diagnóstico baseado em publicações anteriores.4,9
TRATAMENTO DE BKVN
O melhor tratamento para BKVN é um diagnóstico precoce da doença a fim de agir antes que sejam causados danos renais.
Por esta razão, os Guias KDIGO10 sugerem a utilização de um processo de rastreio para todos os pacientes de transplante renal, testando os níveis mensais de Vm durante os primeiros 3 meses (2D) e a cada três meses até ao final do primeiro ano (2D), sempre que a disfunção renal seja produzida sem causa alternativa visível (2D), e após tratamento para en episódio de rejeição aguda (2D). Sugere-se também uma redução na EI quando a Vm é persistentemente superior a 107 cópias/ml (2D).
P>Regredindo a redução na EI, o primeiro passo consiste em implementar o protocolo padrão (não dando CAN ou tratamentos antiproliferativos acima dos níveis indicados para a gama terapêutica), seguido pela medição da viremia a cada 4 semanas, reduzindo a NAb em 15%-20%, reduzindo a supressão de MMF e/ou MMF em 50%, e/ou substituindo TAC por CsA ou um ISP (Figura 6).11
Em relação aos tratamentos antivirais, i.v. imunoglobulinas, ciclofovir, leflunomida, e quinolonas têm sido usadas empiricamente, e a sua eficácia é actualmente difícil de determinar porque não têm sido administradas em combinação com uma redução da SI e devido à falta de estudos prospectivos controlados e aleatórios.
Finalmente, gostaríamos de comentar a retransplantação renal em doentes que perderam um enxerto devido ao BKVN. A recidiva da doença em estudos breves é de 12%. As recomendações que devem ser tidas em conta nestas situações são: 1) informar o paciente sobre o aumento do risco potencial de recorrência de BKVN; 2) confirmar a ausência de replicação viral (PCR de sangue e urina quando o paciente é incluído na lista de transplantes e, posteriormente, de 6 em 6 meses), o paciente deve receber o transplante com resultados negativos de PCR de amostras de sangue, e 3) adaptar o IS à patologia.12-14
PONTOS-CHAVE
1. As formas poderosas e modernas de imunossupressão podem ser responsáveis pela prevalência crescente desta infecção
2. A infecção pelo vírus BK em doentes imunocomprometidos pode afectar a função e sobrevivência dos transplantes renais
3. O diagnóstico precoce através da monitorização rigorosa da contagem de células engodo urinário e/ou virúria e viremia é crucial para evitar os impactos negativos desta complicação
4. Não existem provas de um tratamento específico eficaz para esta infecção. Apenas uma redução no tratamento imunossupressor pode minimizar a virulência.
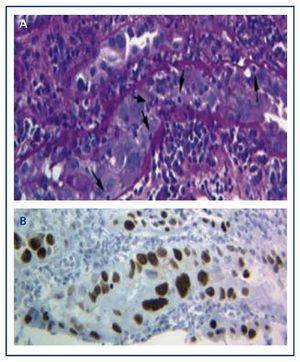
Figure 1. Inclusões de vírus nucleares basofílicos em células epiteliais e tubulite no vírus BK nefropatia (a) e imunohistoquímica para o antigénio SV-40 LTAg (b)

Figure 2. Padrões histológicos da nefropatia associada ao vírus BK
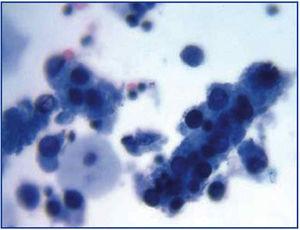
Figure 3. Disperse células de engodo e cilindros celulares contendo células de engodo compactadas. Quando aparecem, estes cilindros são patogénicos de lesão renal
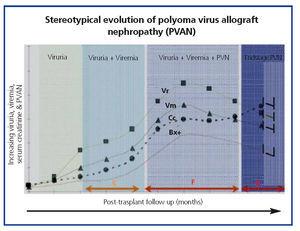
Figure 4. Fases de evolução da nefropatia associada ao vírus BK
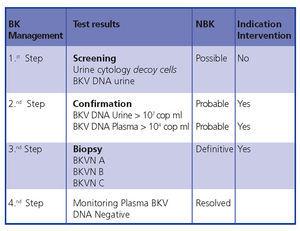
Figure 5. Algoritmo de diagnóstico BKVN

Figure 6. Algoritmo de tratamento BKVN