What is Reflux?
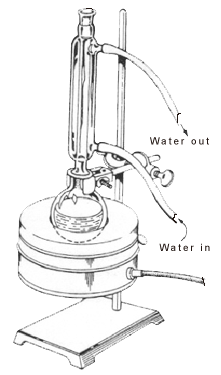
Muitas reacções químicas orgânicas demoram muito tempo a completar, e a fim de acelerar estas reacções, é aplicado calor. Os compostos orgânicos são frequentemente voláteis, com altas pressões de vapor e baixos pontos de ebulição. Quando aquecidos até certo ponto, tornam-se inflamáveis e resultam em explosões. Assim, a aplicação de calor deve ser feita de uma forma específica para superar a questão da evaporação de demasiado solvente e da secagem do recipiente de reacção.
Refluxo envolve o aquecimento da reacção química durante um período de tempo específico, enquanto se arrefece continuamente o vapor produzido de volta à forma líquida, utilizando um condensador. Os vapores produzidos acima da reacção sofrem continuamente condensação, regressando ao frasco como condensado. Desta forma, garante que a temperatura da reacção permanece constante.
Os reagentes para experiências de refluxo podem ser sólidos e líquidos, ou ambos os líquidos. A temperatura a que a reacção é aquecida depende dos pontos de ebulição dos solventes e também do anel de refluxo (ver abaixo).
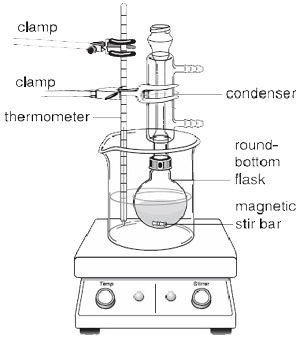
Se os reagentes adicionados ao Balão de Fundo Redondo não forem demasiado viscosos, pode ser utilizada uma barra de agitação magnética para evitar a colisão violenta do líquido em ebulição e assegurar um aquecimento uniforme. Como mostra a figura 2, deve ser utilizada uma placa quente no lugar de um manto de aquecimento quando se utiliza uma barra de agitação magnética, porque contém um agitador magnético que permite que a barra seja rodada automaticamente enquanto o refluxo está a ocorrer
O condensador está sempre completamente cheio de água para assegurar um arrefecimento eficiente. Os vapores, que são libertados da mistura de reacção líquida, passam da fase gasosa para a fase líquida devido à perda de calor. Isto faz com que a mistura líquida volte a cair no balão de fundo redondo.
Durante a reacção, uma parte do solvente percorre o tubo do condensador antes de condensar de novo no balão. Acima deste ponto, a camisa interior do condensador parecerá seca. Abaixo deste ponto, o solvente flui de volta para o frasco. O limite entre estas duas porções é o anel de refluxo. A temperatura da reacção deve ser regulada de modo a que o anel de refluxo seja apenas de um terço a meio do condensador.
Para saber que o ponto de ebulição foi atingido, são produzidas bolhas de vapor no interior do líquido. Se a taxa de aquecimento for aumentada, a temperatura dos reagentes não se altera, mas a taxa a que o líquido em ebulição se transforma em vapor aumenta. Este aumento é causado pelo aumento do fornecimento de energia que facilita mais moléculas líquidas a superar as suas interacções intermoleculares para entrar na fase gasosa.
Quando uma mistura de dois ou mais compostos voláteis é aquecida, a pressão total de vapor (PT) da mistura é igual à soma das pressões de vapor dos compostos 1 e 2 (P1 e P2) na mistura. A magnitude da pressão de vapor exercida por cada composto é determinada pela pressão de vapor desse composto (P0) e pelas fracções moles de ambos os compostos 1 e 2 presentes na mistura (X1 e X2).
Para uma solução ideal com dois componentes, a pressão de vapor da solução é expressa pela Lei de Raoult, mostrada na equação abaixo:
PT = X1P10 + X2P20
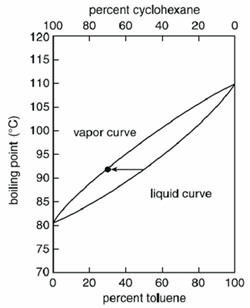
Dependente da mistura, a temperatura ferve de forma variável. As misturas homogéneas fervem a uma temperatura entre os pontos de ebulição dos compostos puros, mas o valor exacto depende da quantidade (massa ou volume) de cada composto.
Por exemplo, uma mistura líquida quando fervida produzirá um vapor que conterá uma percentagem maior do composto mais volátil. Numa mistura de ciclohexano e tolueno, o ciclohexano é mais volátil entre os dois e um líquido composto de 50% de ciclohexano e 50% de tolueno ferveria a 90°C e produziria um vapor composto de 70% de ciclohexano e 30% de tolueno.
Quando se trata de separar compostos, um método comum utilizado na química orgânica é a destilação que separa os compostos com base nas diferenças nos pontos de ebulição.
Em experiências mais sofisticadas, o refluxo e a destilação podem ser realizados ao mesmo tempo. Por exemplo, enquanto uma reacção é refluxo, uma destilação em microescala pode ser levada a cabo utilizando equipamento especializado. A destilação em microescala é para encurtar o caminho da destilação para reduzir a possibilidade de perda de material no processo.
 |
 |
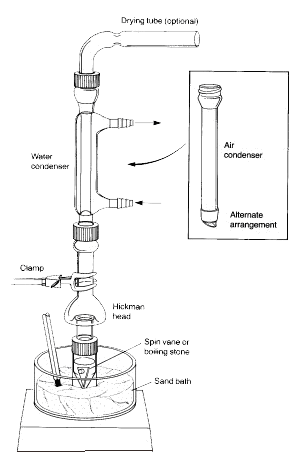
Sidenote: Os vapores do líquido aquecido sobem e arrefecem para condensar nas paredes interiores da cabeça do Hickman ou nas paredes do condensador.
O líquido que drena para baixo acumula-se no poço circular no fundo do alambique.
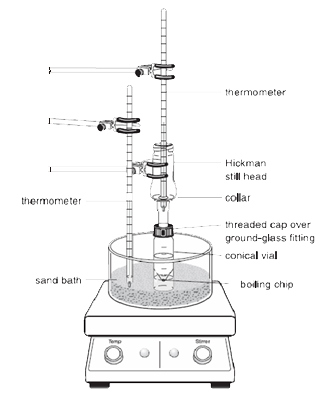
1.O frasco cónico deve ser firmemente fixado à cabeça de destilação Hickman e ao condensador de ar utilizando a tampa de compressão e a braçadeira metálica. Todas as peças devem ter uma junta de vidro esmerilado e encaixar bem de modo a que não ocorram fugas importantes.
2.A palheta de centrifugação deve ser colocada no frasco cónico e apontada para baixo. O septo plano e a pequena tampa de compressão são utilizados para fechar a porta lateral da cabeça do Hickman. Toda a instalação é colocada no buraco apropriado no banho de areia ou Al-block e centrada na placa de aquecimento antes de começar a mexer (caso contrário, a palheta de centrifugação virará e rodará incorrectamente).
3. A cabeça Hickman e o condensador de ar têm de ser arrefecidos com uma toalha de papel molhada. A fonte de calor deve ser regulada de modo a que o composto de interesse se destile lentamente.
Na configuração acima, a cabeça de destilação Hickman actua como condensador de ar e recipiente de recolha de condensado para destilações simples ou fraccionadas. A cabeça Hickman pode ser separada em dois tipos: portada e não portada.
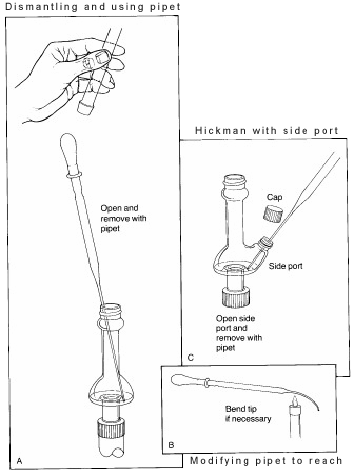
É mais fácil recolher fracções com a cabeça de Hickman portada. Para tal, a porta deve ser aberta para remover o líquido no poço com uma pipeta Pasteur (ver ‘C’ na Figura 3).
Para a cabeça Hickman não portada, a pipeta Pasteur é utilizada para extrair o líquido do topo. (ver ‘A’).
Se for utilizado um condensador ou termómetro interno, o aparelho de destilação deve ser parcialmente desmontado para o fazer. Em alguns alambiques, o diâmetro interno da cabeça é tão pequeno que é difícil de alcançar num ângulo com a pipeta e fazer contacto com o líquido. Para resolver este problema, a ponta da pipeta deve ser ligeiramente dobrada numa chama.
Após retirado, o líquido é transferido para um pequeno frasco e coberto com uma tampa selada de Teflon. Se houver mais do que um composto volátil no frasco, será necessário começar com baixo calor para destilar primeiro o composto com menor ebulição. Desta forma, compostos com uma diferença de ponto de ebulição de pelo menos 50 oC podem ser separados de forma relativamente limpa.
No final, algumas palavras de conselho:
1. O frasco cónico não deve ser mais de meio cheio para deixar espaço suficiente para o líquido ferver. Caso contrário, a solução irá derramar para fora ou para fora quando começar a ferver.
2. Uma boa vedação entre as juntas minimiza a perda do composto alvo durante a destilação. Também evita o gotejamento de um composto sobre a placa de aquecimento, e um possível acidente de incêndio.