Obiettivi
Dopo aver completato questa sezione, dovresti essere in grado di
- scrivere un’equazione per descrivere la formazione di una cianoidrina da un’aldeide o un chetone.
- identificare la cianoidrina formata dalla reazione di una data aldeide o chetone con acido cianidrico.
- identifica l’aldeide o il chetone, i reagenti, o entrambi, necessari per preparare una data cianoidrina.
- scrivi il meccanismo dettagliato per l’aggiunta di acido cianidrico a un’aldeide o a un chetone.
Termini chiave
Assicurati di poter definire, e usare nel contesto, il termine chiave qui sotto.
- cianoidrina
Note di studio
Per una buona formazione di cianoidrina è importante avere a disposizione ioni cianuro liberi per reagire con il chetone o l’aldeide. Questo può essere ottenuto usando un sale (per esempio KCN o NaCN) o una forma sililata (per esempio Me3SiCN) di cianuro in condizioni acide o usando HCN con qualche base aggiunta per produrre il nucleofilo CN necessario.
Il cianuro di idrogeno (HC≡N), si aggiunge reversibilmente alle aldeidi e a molti chetoni formando addotti idrossialcanitrile (comunemente conosciuti e chiamati cianoidrine). Le cianoidrine hanno la formula strutturale di R2C(OH)CN. La “R” sulla formula rappresenta un alchile, un arile o un idrogeno.
Figura 19.6.1: Reazione generale di formazione delle cianoidrine
Una caratteristica importante della formazione delle cianoidrine è che richiede un catalizzatore di base. Poiché l’acido cianidrico è esso stesso un acido (pKa = 9,25), i migliori risultati si hanno quando una piccola quantità di una base forte attiva l’acido cianidrico convertendolo in ione cianuro ((-)C≡N), che può funzionare come nucleofilo del carbonio. In assenza di base, la reazione non procede, o al massimo è molto lenta. La formazione della cianoidrina è debolmente esotermica, ed è favorita per le aldeidi, e per i chetoni ciclici e metilici non ostacolati.
Nelle sintesi pratiche delle cianoidrine, è conveniente aggiungere un acido forte a una miscela di cianuro di sodio e il composto carbonilico, in modo che l’acido cianidrico sia generato in situ. La quantità di acido aggiunto dovrebbe essere insufficiente a consumare tutto lo ione cianuro, quindi si mantengono condizioni sufficientemente alcaline per una rapida aggiunta.
Anche l’idrolisi catalizzata dall’acido delle cianoidrine sililate (R3SiCN) ha dimostrato di essere una fonte di acido cianidrico per formare cianoidrine anche con chetoni altamente ostacolati.
2 (CH3)3SiCN + H2O → (CH3)3SiOSi(CH3)3 + 2 HCN
Il cianuro di idrogeno si aggiunge attraverso il doppio legame carbonio-ossigeno in aldeidi e chetoni per produrre composti noti come idrossinitrili. Per esempio, con etanale (un’aldeide) si ottiene 2-idrossipropanenitrile:
Con propanone (un chetone) si ottiene 2-idrossi-2-metilpropanitrile:
La reazione normalmente non viene fatta usando l’acido cianidrico, perché è un gas estremamente tossico. Invece, l’aldeide o il chetone viene mescolato con una soluzione di cianuro di sodio o di potassio in acqua a cui è stato aggiunto un po’ di acido solforico. Il pH della soluzione è regolato a circa 4 – 5, perché questo dà la reazione più veloce. La soluzione conterrà idrogeno cianuro (dalla reazione tra il cianuro di sodio o di potassio e l’acido solforico), ma contiene ancora alcuni ioni cianuro liberi. Questo è importante per il meccanismo.
Meccanismo di formazione della cianoidrina
1) Nel primo passo lo ione cianuro agisce come nucleofilo e forma un legame con il carbonio carbonile elettrofilo. I due elettroni nel legame pi carbonile sono spinti sull’ossigeno elettronegativo formando uno ione alcossido tetraedrico intermedio.
2) Lo ione alcossido viene protonato da HCN che rigenera lo ione cianuro.
Altra chimica delle cianoidrine
I gruppi funzionali delle cianoidrine si rivelano spesso utili per l’ulteriore chimica che può essere svolta grazie alla presenza di una funzionalità idrossile e nitrile. In particolare, la disidratazione può convertire il gruppo idrossile in un alchene (sezione 17.6). Il nitrile può essere convertito in un gruppo funzionale acido carbossilico attraverso la reazione con una soluzione acquosa acida calda (sezione 20.7). Inoltre, il nitrile può essere ridotto dall’aggiunta di LiAlH4 per formare un’ammina primaria. La formazione di una cianoidrina permette di convertire facilmente aldeidi e chetoni in un’ampia varietà di gruppi funzionali.
Altre cianoidrine
Altre cianoidrine interessanti sono: mandelonitrile, cianoidrina di acetone, e glicolonitrile.
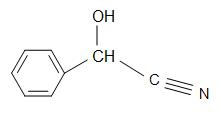

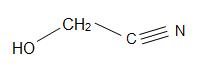
Strutture di Madelonitrile (sinistra), Acetone cianoidrina (centro), e glicolonitrile (destra)
Mandelonitrile ha una formula strutturale di C6H5CH(OH)CN e si trova nei noccioli di alcuni frutti. L’acetone cianoidrina ha la struttura, (CH3)2C(OH)CN, ed è usato nella produzione di metil metacrilato (noto anche come acrilico). Il glicolonitrile è un composto organico con la formula strutturale di HOCH2CN, che è la più semplice cianoidrina derivata dalle formaldeidi.
Problemi
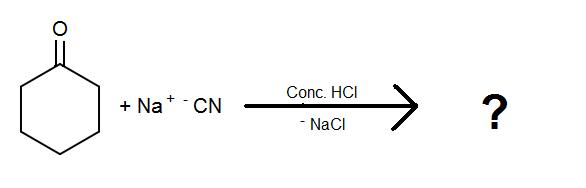
Completa le seguenti reazioni per le cianoidrine:
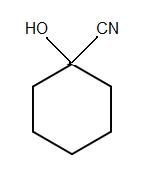
1)
2)
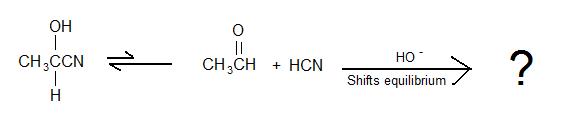
3) Vero o falso: Per la formazione di una cianoidrina, viene effettuata una rapida aggiunta di un acido forte al sale di cianuro per convertire il sale in HCN.
4) Vero o falso: Le reazioni di cianoidrina sono irreversibili.
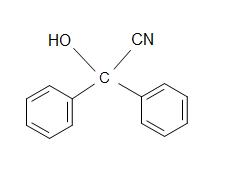
5) Qual è il prodotto della reazione complessiva?
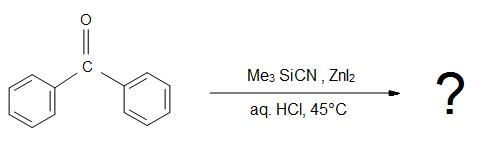
Risposte
1)
2)
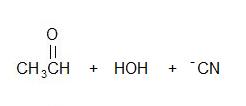
3) Falso, aggiunta lenta
4) Falso, reversibile
5)
Contributori e attribuzioni
-
Dr. Dietmar Kennepohl FCIC (Professore di Chimica, Athabasca University)
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, Professore Emerito (Michigan State U.), Virtual Textbook of Organic Chemistry
-
Jim Clark (Chemguide.co.uk)