INTRODUZIONE
I virus sono agenti patogeni particolarmente problematici nei trapiantati, poiché la questione delle infezioni virali nei trapianti riflette un complesso equilibrio tra le varie infezioni virali che un paziente può avere nel corso della sua vita, la risposta immunitaria antivirale del ricevente e il livello di immunosoppressione richiesto per garantire un innesto funzionante.
L’infezione da polyomavirus BK (BKV) è un problema emergente nei trapianti di rene, ed è considerato il prezzo pagato per la moderna e potente immunosoppressione (IS).
ASPETTI BIOLOGICI DEL VIRUS
Il polyomavirus, insieme al papillomavirus, appartiene alla famiglia dei papovavirus. Il virus BK (BKV) appartiene alla famiglia dei polyomavirus insieme ad altri polyomavirus che sono stati individuati nell’uomo, come il virus JC (JCV), il virus KI, il virus WU, il virus del carcinoma a cellule di Merkel e il virus 40 della Simian (SV40).
Sono virus piccoli, non sviluppati, con un diametro di 42 nm. Il capside ha una simmetria icosaedrica e ospita un genoma a doppia catena circolare di DNA con oltre 5000 paia di basi, composto da una regione “precoce” che è altamente conservata e codifica per l'”antigene T/t” (TAg), che è implicato nella trasformazione, nella replicazione virale e nella regolazione ed espressione genica; e una regione “tardiva” che codifica per le tre proteine del capside, note come VP1, VP2 e VP3, e per una proteina chiamata “agnoproteina”, una regione regolatrice non codificante situata tra le altre due, dove si trovano i determinanti per la replicazione, l’unione TAg e gli elementi di regolazione trascrizionale.
Il polyomavirus possiede una specificità di adattamento al suo ospite; quindi, la sua evoluzione è probabilmente associata all’evoluzione della specie ospite, e quindi l’infezione naturale si verifica solo in un numero limitato di specie strettamente correlate, costituendo un marcatore per stabilire le differenze razziali tra gli esseri umani.
Utilizzando l’analisi di sequenziamento genico, sono stati stabiliti diversi genotipi: Europeo, Asiatico e Africano. Il resto dei genotipi corrisponde a ricombinazioni di questi tre, e sebbene la sua origine sia difficile da stabilire, lo studio di questo virus potrebbe fornire uno strumento per aiutare a comprendere l’evoluzione delle migrazioni umane.
BKV è associato a due complicazioni osservate nei riceventi di trapianto: La nefropatia associata al virus BK (BKVN) nei trapianti di rene e la cistite emorragica nei trapianti di midollo osseo. In contrasto con il BKV, sebbene il JCV risieda nell’uroepitelio e normalmente si riattivi, raramente produce nefropatia, ma è associato a leucoencefalopatia multifocale ed encefalite. SV40, che proviene dalle scimmie, è stato introdotto nella popolazione umana attraverso vaccini contaminati con polio e adenovirus, e sebbene la sua presenza sia stata rilevata in biopsie di reni trapiantati, la sua importanza nel trapianto di rene non è ancora ben definita.
EPIDEMIOLOGIA E FATTORI DI RISCHIO
L’infezione primaria avviene in modo subclinico durante la prima decade di vita, con una sieroprevalenza di oltre l’80% nella popolazione adulta.
La fonte di infezione è esclusivamente umana, non è stato dimostrato che gli animali fungano da serbatoi, e la via di trasmissione può essere fecale-orale, respiratoria, transplacentare e attraverso tessuti donati. Durante la fase viremica, il virus infetta i tessuti, l’urotelio, il tessuto linfatico e il cervello, producendo un’infezione litica latente.
Dopo la trasmissione virale naturale durante l’infanzia, il BKV rimane nel tratto urinario con riattivazioni intermittenti e bassi livelli di viruria (Vr), 5%-10% negli adulti immunocompetenti.1,2 Negli individui immunocompromessi, la frequenza di BK Vr aumenta al 20%-60%, e sono frequenti anche livelli ancora maggiori di viruria e la comparsa di cellule esca nelle urine.3
Nel trapianto di rene, la prevalenza delle nefropatie associate al virus BK (BKVN) oscilla tra l’1% e il 10%,4 basandosi più sul trattamento immunosoppressivo e sui metodi diagnostici che su reali differenze epidemiologiche.
Nel 2004, il trattamento dell’infezione da BKV dopo il trapianto di rene è stato inserito nel database americano come variabile per l’evoluzione post-trapianto (TBKV); i dati sono stati successivamente analizzati, ottenendo un totale di >48 000 trapianti, 1474 dei quali trattati entro 24 mesi. L’incidenza cumulativa di TBKV è aumentata con il tempo, passando dal 3,45% a 24 mesi al 6,6% a 60 mesi dal trapianto.
Il fallimento del trapianto secondario a BKVN si verifica ad un tasso del 50%-100% a 24 mesi nei centri che non hanno programmi di screening, il che evidenzia l’importanza di una diagnosi precoce della malattia.5
Diversi protocolli di IS sono stati identificati come fattori di rischio per lo sviluppo di BKVN, in particolare l’uso di terapie triple con farmaci anticalcinesurici, micofenolato mofetile (MMF) e steroidi,5,6 ma casi di BKVN sono stati descritti anche quando si usavano altri regimi di IS, il che indica che l’intensità del trattamento IS, e non il farmaco specifico in sé, è il fattore di rischio in questo caso. Esistono anche altri tipi di fattori di rischio, come i fattori del paziente (maschi >50 anni di età, ricevente sieronegativo al BKV), fattori dell’innesto (donatore sieropositivo al BKV, incompatibilità HLA, danno immunologico o ischemico) e fattori virali (carica virale latente, sierotipo del capside e capacità di replicazione).7
DIAGNOSI ISTOLOGICA DELLA BKVN E PROGRESSIONE
Le cellule di decoy, la viruria e la viremia indicano solo la replicazione virale, non la nefropatia, ma sono strumenti chiave per la prevenzione e il monitoraggio della malattia.
L’unico segno clinico della BKVN è il deterioramento della funzione renale, e quando questo avviene, è già troppo tardi per intervenire, poiché il danno renale è già stato prodotto.
La diagnosi della malattia può essere fatta solo con una biopsia del trapianto in cui si trovano le tipiche inclusioni virali nucleari basofile nelle cellule epiteliali (tubulari, capsula di Bowman e/o urotelio), e segni di infiammazione con tubulite (Figura 1A), risultati simili a quelli che appaiono nel rigetto acuto del trapianto da parte dei linfociti T. Solo utilizzando la tecnica immunoistochimica per SV-40 LTAg possiamo osservare una colorazione nucleare positiva e identificare il polyomavirus (BK, JC) come responsabile dell’infiammazione, scartando così la diagnosi di rigetto acuto delle cellule T (Figura 1B) e confermando la diagnosi di BKVN.
Le lesioni istologiche BKVN sono focali ed eterogenee e quindi una biopsia negativa non può escludere la diagnosi. Come tale, questo test deve essere ripetuto se la carica virale nel sangue del paziente rimane persistentemente alta.
I modelli istologici della BKVN2,8,9 si basano sull’identificazione e sull’estensione dell’infiltrato infiammatorio e della fibrosi associata all’infezione virale, il che permette di stabilire tre modelli istologici (Figura 2).
EVOLUZIONE CLINICA E OPPORTUNITÀ DI PREVENZIONE E DIAGNOSI PRECOCE
La comune evoluzione clinica della BKVN9 è rappresentata nella Figura 3, che mostra come lo sviluppo della malattia sia previsto dalla comparsa della viruria BK (BK Vr), conseguenza della riattivazione e replicazione virale nelle vie urinarie, con la comparsa delle tipiche cellule esca (figura 4), facilmente identificabili con gli esami citologici delle urine di routine. Tuttavia, la quantificazione del Vr mediante tecniche di PCR è più sensibile rispetto alla citologia e permette di distinguere tra le infezioni da BKV e JCV.
Quando la viruria è >105 copie/ml e persiste, è seguita settimane o mesi dopo dallo sviluppo della viremia (Vm) a >107 copie/ml e, infine, BKVN. BK Vr non è diagnostico di danno parenchimale renale, ma la comparsa simultanea di Vm e Vr è patognomonico di danno parenchimale renale (BKVN). Il mantenimento o, più tipicamente, l’aumento della Vm è un fattore predittivo di deterioramento della funzione renale ed è correlato alla presenza e alla gravità delle lesioni istologiche. Nei pazienti con funzione renale normale o moderatamente bassa, la probabilità di trovare indicatori istologici di BKVN è direttamente proporzionale alla durata e alla gravità della viremia. Una viremia elevata e sostenuta identifica i pazienti con una replicazione virale incontrollata che porta al danno renale.
In conclusione, una diagnosi e un intervento precoci minimizzano il danno al trapianto. La figura 5 mostra un algoritmo diagnostico basato su pubblicazioni precedenti.4,9
Trattamento della BKVN
Il miglior trattamento per la BKVN è una diagnosi precoce della malattia al fine di agire prima che il danno renale sia causato.
Per questo motivo, le guide KDIGO10 suggeriscono di utilizzare un processo di screening per tutti i pazienti trapiantati di rene, analizzando mensilmente i livelli di Vm durante i primi 3 mesi (2D) e ogni tre mesi fino alla fine del primo anno (2D), ogni volta che si produce una disfunzione renale senza cause alternative visibili (2D) e dopo il trattamento di un episodio di rigetto acuto (2D). Una riduzione dell’IS è suggerita anche quando la Vm è persistentemente maggiore di 107 copie/ml (2D).
Per quanto riguarda la riduzione dell’IS, il primo passo consiste nell’attuare il protocollo standard (non somministrare CAN o trattamenti antiproliferativi al di sopra dei livelli indicati per il range terapeutico), seguito dalla misurazione della viremia ogni 4 settimane, dalla riduzione dei NAb del 15%-20%, dalla riduzione del MMF e/o dalla soppressione del MMF del 50%, e/o dalla sostituzione della TAC con la CsA o un ISP (Figura 6).11
Per quanto riguarda i trattamenti antivirali, le immunoglobuline i.v., il ciclofovir, la leflunomide e i chinoloni sono stati usati empiricamente, e la loro efficacia è attualmente difficile da determinare perché non sono stati somministrati in combinazione con una riduzione dell’IS e per la mancanza di studi prospettici controllati e randomizzati.
Infine, vorremmo commentare il trapianto di rene in pazienti che hanno perso un innesto a causa della BKVN. La ricorrenza della malattia in studi brevi è del 12%. Le raccomandazioni che devono essere prese in considerazione in queste situazioni sono: 1) informare il paziente sull’aumentato rischio potenziale di recidiva di BKVN; 2) confermare l’assenza di replicazione virale (PCR del sangue e delle urine quando il paziente viene inserito nella lista di trapianto e successivamente ogni 6 mesi), il paziente deve ricevere il trapianto con risultati negativi della PCR dai campioni di sangue, e 3) adattare l’IS alla patologia.12-14
PUNTI CHIAVE
1. Le potenti e moderne forme di immunosoppressione potrebbero essere responsabili della crescente prevalenza di questa infezione
2. L’infezione da virus BK in pazienti immunocompromessi potrebbe influenzare la funzione e la sopravvivenza dei trapianti di rene
3. La diagnosi precoce attraverso il monitoraggio rigoroso della conta delle cellule di decoy nelle urine e/o della viruria e della viremia è fondamentale per evitare gli impatti negativi di questa complicazione
4. Non esistono prove di un trattamento efficace specifico per questa infezione. Solo una riduzione del trattamento immunosoppressivo può minimizzare la virulenza.
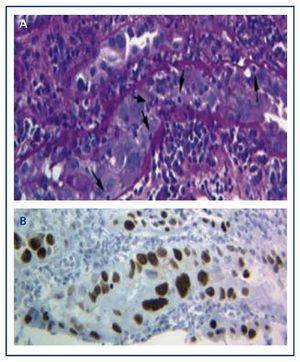
Figura 1. Inclusioni virali nucleari basofile nelle cellule epiteliali e tubuliti nella nefropatia da virus BK (a) e immunoistochimica per l’antigene SV-40 LTAg (b)

Figura 2. Modelli istologici della nefropatia associata al virus BK
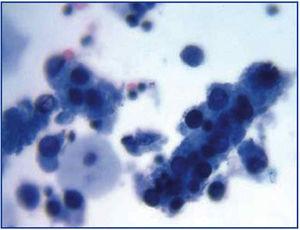
Figura 3. Cellule esca disperse e cilindri cellulari contenenti cellule esca compattate. Quando appaiono, questi cilindri sono patognomici del danno renale
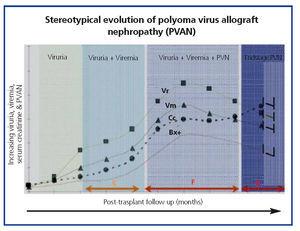
Figura 4. Fasi di evoluzione della nefropatia associata al virus BK
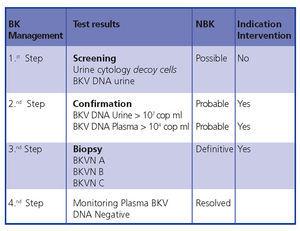
Figura 5. Algoritmo diagnostico di BKVN

Figura 6. Algoritmo di trattamento di BKVN