 La tavola periodica è organizzata come una grande griglia. Ogni elemento è collocato in una posizione specifica a causa della sua struttura atomica. Come ogni griglia, la tavola periodica ha righe (da sinistra a destra) e colonne (su e giù). Ogni riga e colonna ha caratteristiche specifiche. Per esempio, il magnesio (Mg) e il calcio (Mg) si trovano nella colonna due e condividono alcune somiglianze, mentre il potassio (K) e il calcio (Ca) della riga quattro hanno caratteristiche diverse. Il magnesio e il sodio (Na) condividono anche delle qualità perché sono nello stesso periodo (configurazioni elettroniche simili).
La tavola periodica è organizzata come una grande griglia. Ogni elemento è collocato in una posizione specifica a causa della sua struttura atomica. Come ogni griglia, la tavola periodica ha righe (da sinistra a destra) e colonne (su e giù). Ogni riga e colonna ha caratteristiche specifiche. Per esempio, il magnesio (Mg) e il calcio (Mg) si trovano nella colonna due e condividono alcune somiglianze, mentre il potassio (K) e il calcio (Ca) della riga quattro hanno caratteristiche diverse. Il magnesio e il sodio (Na) condividono anche delle qualità perché sono nello stesso periodo (configurazioni elettroniche simili). 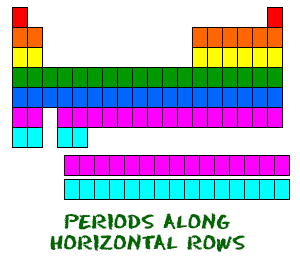
…e i tuoi gruppi
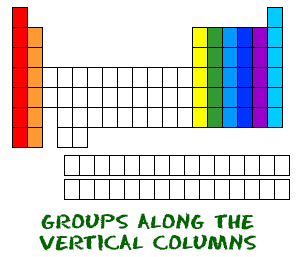 Ora sai dei periodi che vanno da sinistra a destra. La tavola periodica ha anche un nome speciale per le sue colonne verticali. Ogni colonna è chiamata gruppo. Gli elementi di ogni gruppo hanno lo stesso numero di elettroni nell’orbitale esterno. Questi elettroni esterni sono anche chiamati elettroni di valenza. Sono gli elettroni coinvolti nei legami chimici con altri elementi.
Ora sai dei periodi che vanno da sinistra a destra. La tavola periodica ha anche un nome speciale per le sue colonne verticali. Ogni colonna è chiamata gruppo. Gli elementi di ogni gruppo hanno lo stesso numero di elettroni nell’orbitale esterno. Questi elettroni esterni sono anche chiamati elettroni di valenza. Sono gli elettroni coinvolti nei legami chimici con altri elementi.
Ogni elemento nella prima colonna (gruppo uno) ha un elettrone nel suo guscio esterno. Ogni elemento nella seconda colonna (gruppo due) ha due elettroni nel guscio esterno. Continuando a contare le colonne, saprai quanti elettroni ci sono nel guscio esterno. Ci sono eccezioni all’ordine quando guardi gli elementi di transizione, ma hai l’idea generale. Gli elementi di transizione aggiungono elettroni al penultimo orbitale.
Per esempio, l’azoto (N) ha il numero atomico sette. Il numero atomico ti dice che ci sono sette elettroni in un atomo neutro di azoto. Quanti elettroni ci sono nel suo orbitale esterno? L’azoto è nella quindicesima colonna, etichettata come ‘Gruppo VA’. La ‘V’ è il numero romano per cinque e rappresenta il numero di elettroni nell’orbitale esterno. Tutte queste informazioni ti dicono che ci sono due elettroni nel primo orbitale e cinque nel secondo (2-5).
Il fosforo (P) è anche nel gruppo VA, il che significa che ha anche cinque elettroni nel suo orbitale esterno. Tuttavia, poiché il numero atomico del fosforo è quindici, la configurazione degli elettroni è 2-8-5.
Due in cima
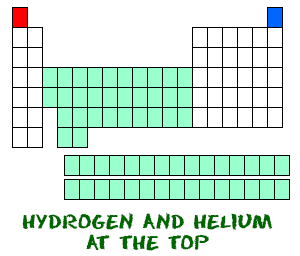 Idrogeno (H) ed elio (He) sono elementi speciali. L’idrogeno, nella sua forma neutra, non ha un neutrone. Ci sono solo un elettrone e un protone. Probabilmente non troverai idrogeni atomici che galleggiano da soli. L’idrogeno atomico vuole combinarsi con altri elementi per riempire il suo guscio esterno. Il tuo lavoro di chimica userà molto probabilmente idrogeno molecolare (H2) o ioni di idrogeno (H+, protoni).
Idrogeno (H) ed elio (He) sono elementi speciali. L’idrogeno, nella sua forma neutra, non ha un neutrone. Ci sono solo un elettrone e un protone. Probabilmente non troverai idrogeni atomici che galleggiano da soli. L’idrogeno atomico vuole combinarsi con altri elementi per riempire il suo guscio esterno. Il tuo lavoro di chimica userà molto probabilmente idrogeno molecolare (H2) o ioni di idrogeno (H+, protoni).
L’elio (He) è diverso da tutti gli altri elementi. È molto stabile con solo due elettroni nel suo orbitale esterno (guscio di valenza). Anche se ha solo due elettroni, è ancora raggruppato con i gas nobili che hanno otto elettroni nei loro orbitali più esterni. I gas nobili e l’elio sono tutti “felici”, perché il loro guscio di valenza è pieno.
Video correlati…
Wikipedia: Tavola periodica
Encyclopedia.com: Tavola Periodica