Che cos’è il riflusso?
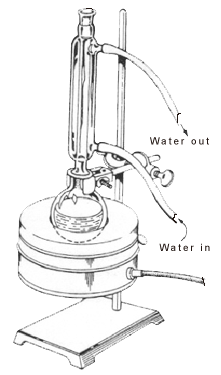
Molte reazioni chimiche organiche richiedono molto tempo per essere completate, e per accelerare queste reazioni, viene applicato il calore. I composti organici sono spesso volatili con alte pressioni di vapore e bassi punti di ebollizione. Quando vengono riscaldati fino a un certo punto, diventano infiammabili e provocano esplosioni. Quindi, l’applicazione del calore deve essere fatta in un modo specifico per superare il problema dell’evaporazione di troppo solvente e dell’essiccazione del recipiente di reazione.
Il riflusso comporta il riscaldamento della reazione chimica per un tempo specifico, mentre il vapore prodotto viene continuamente raffreddato in forma liquida, utilizzando un condensatore. I vapori prodotti sopra la reazione subiscono continuamente la condensazione, ritornando nel pallone come condensato. In questo modo, si garantisce che la temperatura della reazione rimanga costante.
I reagenti per gli esperimenti di riflusso possono essere solidi e liquidi, o entrambi liquidi. La temperatura alla quale la reazione viene riscaldata dipende dai punti di ebollizione dei solventi e anche dall’anello di riflusso (vedi sotto).
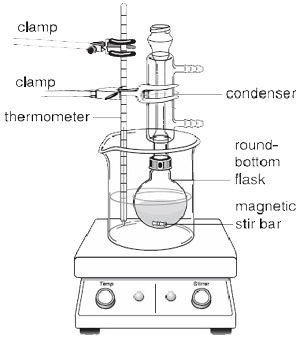
Se i reagenti aggiunti al pallone a fondo rotondo non sono troppo viscosi, si può utilizzare un’ancoretta magnetica per prevenire violenti urti del liquido in ebollizione e assicurare un riscaldamento uniforme. Come mostrato nella figura 2, al posto del mantello riscaldante, quando si usa un’ancoretta magnetica, si dovrebbe usare una piastra calda, perché contiene un agitatore magnetico che permette di far girare automaticamente la barra mentre avviene il riflusso
Il condensatore è sempre completamente riempito di acqua per assicurare un raffreddamento efficiente. I vapori, che si sprigionano dalla miscela liquida di reazione, passano dalla fase gassosa alla fase liquida a causa della perdita di calore. Questo causa poi la caduta della miscela liquida nel pallone a fondo rotondo.
Durante la reazione, una parte del solvente risale il tubo del condensatore prima di condensare di nuovo nel pallone. Sopra questo punto, il rivestimento interno del condensatore apparirà asciutto. Sotto questo punto, il solvente rifluisce nel pallone. Il confine tra queste due porzioni è l’anello di riflusso. La temperatura della reazione deve essere impostata in modo che l’anello di riflusso sia da un terzo a metà del condensatore.
Per sapere che il punto di ebollizione è stato raggiunto, si producono bolle di vapore all’interno del liquido. Se la velocità di riscaldamento viene aumentata, la temperatura dei reagenti non cambia, ma la velocità con cui il liquido bollente si trasforma in vapore aumenta. Questo aumento è causato dalla maggiore fornitura di energia che facilita un maggior numero di molecole di liquido a superare le loro interazioni intermolecolari per entrare nella fase gassosa.
Quando una miscela di due o più composti volatili viene riscaldata, la pressione di vapore totale (PT) della miscela è uguale alla somma delle pressioni di vapore del composto 1 e 2 (P1 e P2) nella miscela. La grandezza della pressione di vapore esercitata da ogni composto è determinata dalla pressione di vapore di quel composto (P0) e dalle frazioni molari di entrambi i composti 1 e 2 presenti nella miscela (X1 e X2).
Per una soluzione ideale di due composti, la tensione di vapore della soluzione è espressa dalla legge di Raoult, mostrata nell’equazione seguente:
PT = X1P10 + X2P20
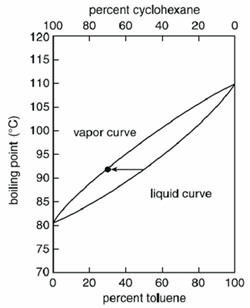
A seconda della miscela, la temperatura bolle in modo variabile. Le miscele omogenee bollono a una temperatura compresa tra i punti di ebollizione dei composti puri, ma il valore esatto dipende dalla quantità (massa o volume) di ciascun composto.
Per esempio, una miscela liquida quando viene bollita produrrà un vapore che conterrà una percentuale maggiore del composto più volatile. In una miscela di cicloesano e toluene, il cicloesano è più volatile dei due e un liquido composto per il 50% da cicloesano e per il 50% da toluene bollirebbe a 90°C e produrrebbe un vapore composto per il 70% da cicloesano e per il 30% da toluene.
Quando si tratta di separare i composti, un metodo comune usato in chimica organica è la distillazione che separa i composti in base alle differenze dei punti di ebollizione.
In esperimenti più sofisticati, il riflusso e la distillazione possono essere eseguiti allo stesso tempo. Per esempio, mentre una reazione sta rifluendo, una distillazione su microscala può essere effettuata utilizzando attrezzature specializzate. La distillazione su microscala serve ad accorciare il percorso di distillazione per ridurre la possibilità di perdita di materiale nel processo.
 |
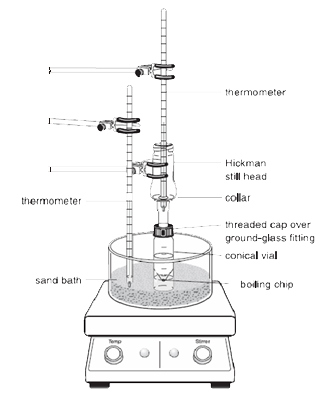 |
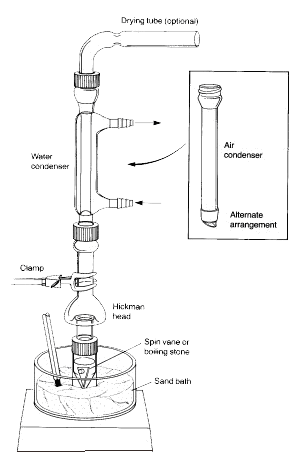
Note: I vapori del liquido riscaldato salgono verso l’alto e si raffreddano per condensare sulle pareti interne della testa di Hickman o sulle pareti del condensatore.
Il liquido che drena verso il basso si raccoglie nel pozzo circolare sul fondo dell’alambicco.
1.La fiala conica deve essere saldamente attaccata alla testa di distillazione Hickman e al condensatore ad aria usando il tappo a compressione e il morsetto di metallo. Tutti i pezzi devono avere una giunzione in vetro smerigliato e combaciare bene in modo che non si verifichino grosse perdite.
2.La paletta di rotazione deve essere posizionata nella fiala conica ed essere rivolta verso il basso. Il setto piatto e il piccolo tappo di compressione sono usati per chiudere la porta laterale della testa di Hickman. L’intero setup viene posizionato nel foro appropriato del blocco Al o del bagno di sabbia e centrato sul piatto caldo prima di iniziare ad agitare (altrimenti la paletta di rotazione si capovolgerà e ruoterà in modo improprio).
3.La testa di Hickman e il condensatore ad aria devono essere raffreddati con un tovagliolo di carta bagnato. La fonte di calore deve essere impostata in modo che il composto di interesse distilla lentamente.
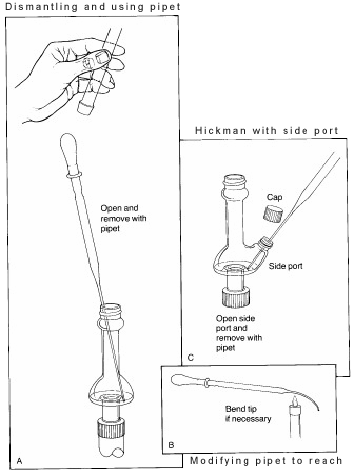
Nel set up di cui sopra, la testa di distillazione Hickman funge sia da condensatore ad aria che da contenitore di raccolta del condensato per distillazioni semplici o frazionate. La testa Hickman può essere separata in due tipi: con e senza porta.
È più facile raccogliere le frazioni con la testa Hickman ported. Per fare ciò la porta deve essere aperta per rimuovere il liquido nel pozzetto con una pipetta Pasteur (vedi ‘C’ in Figura 3).
Per la testa di Hickman senza porta, la pipetta Pasteur è usata per tirare fuori il liquido dalla parte superiore. (vedi ‘A’).
Se si usa un condensatore o un termometro interno, l’apparecchio di distillazione deve essere parzialmente smontato per farlo. In alcuni alambicchi il diametro interno della testa è così piccolo che è difficile entrare in un angolo con la pipetta e fare contatto con il liquido. Per risolvere questo problema, la punta della pipetta deve essere leggermente piegata in una fiamma.
Una volta rimosso, il liquido viene trasferito in una piccola fiala e tappato con un tappo sigillato in teflon.Se c’è più di un composto volatile nella fiala, sarà necessario iniziare a basso calore per distillare prima il composto meno bollente. In questo modo, i composti con una differenza di punto di ebollizione di almeno 50 oC possono essere separati in modo relativamente pulito.
Alla fine, qualche consiglio:
1. La fiala conica non dovrebbe essere riempita più della metà per lasciare abbastanza spazio per l’ebollizione del liquido. Altrimenti la soluzione si rovescia o si rovescia quando inizia a bollire.
2. Una buona tenuta tra le giunture minimizza la perdita del composto target durante la distillazione. Previene anche il gocciolamento di un composto sulla piastra di cottura, e un possibile incidente di fuoco.