Was ist eine vollständige Transposition der großen Arterien?
Eine vollständige Transposition der großen Arterien (TOGA) liegt vor, wenn die Aorta, die normalerweise aus der linken Herzkammer entspringt und rotes Blut in den Körper pumpt, aus der rechten Herzkammer (1) entspringt und blaues Blut, das aus dem Körper zurückfließt, zurück in den Körper pumpt und dabei die Lunge vollständig umgeht. Die Pulmonalarterie, die normalerweise aus dem rechten Ventrikel entspringt und blaues Blut in die Lunge pumpt, entspringt aus dem linken Ventrikel (2) und pumpt rotes Blut, das aus der Lunge zurückfließt, direkt in die Lunge zurück. Im Wesentlichen sind die großen Arterien von ihren normalen Verbindungen vertauscht.
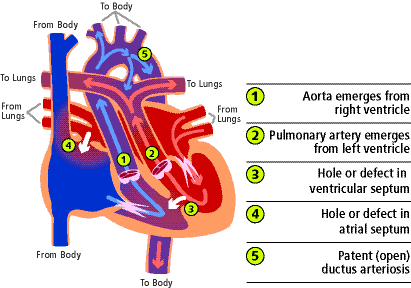
Die Ursache des Problems ist nicht verstanden. Es ist die häufigste Form des zyanotischen angeborenen Herzfehlers, der sich in der Neugeborenenperiode präsentiert. Sie tritt häufiger bei Männern auf und die Babys haben normalerweise ein normales Geburtsgewicht und eine normale Größe. TOGA macht 5 bis 7% aller angeborenen Herzfehler aus.
Es gibt mehrere andere Herzanomalien, die zusammen mit TOGA auftreten können. Die häufigste Begleiterscheinung ist ein Ventrikelseptumdefekt (3). Dabei handelt es sich um einen Defekt oder ein Loch in der Wand, die die unteren beiden Kammern des Herzens, die Ventrikel, voneinander trennt. Es kann zu einer Verengung des Bereichs des Herzens kommen, in dem das Blut zur Lungenarterie fließt. Dies wird als linksventrikuläre Ausflusstraktobstruktion bezeichnet.
Viele dieser Babys haben einen Vorhofseptumdefekt (4) (ein Loch in der Wand, die die oberen beiden Kammern des Herzens trennt) und/oder einen offenen Ductus arteriosus (5). Dies ist ein normaler, bei der Geburt vorhandener Kanal zwischen der Aorta und der Lungenarterie, der sich bei Vorhandensein anderer Herzprobleme nicht schließen kann.
Welche Auswirkungen hat dieser Defekt auf die Gesundheit meines Kindes?
Wenn ein Baby TOGA hat, gibt es zwei getrennte Kreisläufe des Blutflusses statt eines verbundenen. Blaues Blut, das aus dem Körper zurückfließt, wird direkt zurück in den Körper gepumpt und rotes Blut, das aus der Lunge zurückfließt, wird direkt zurück in die Lunge gepumpt. Infolgedessen entwickelt das Baby kurz nach der Geburt eine blaue Farbe, die Zyanose genannt wird. Die blaue Farbe kann am besten an den Lippen oder unter den Fingernägeln bemerkt werden. Bei einem Baby mit herzbedingter Zyanose bessert sich die Blaufärbung nicht durch die Zufuhr von Sauerstoff.
Wenn diese Situation andauern würde, könnte das Baby bald an der mangelnden Sauerstoffzufuhr zum Körper sterben. Die einzige Möglichkeit, wie ein Baby mit TOGA nach der Geburt überleben kann, ist, wenn es eine Möglichkeit gibt, dass sich das rote und blaue Blut im Herzen vermischt, so dass etwas rotes Blut in den Körper gepumpt wird. Ein Vorhofseptumdefekt und/oder ein offener Ductus arteriosus lassen in der Regel genug Sauerstoff zu, damit das Baby überleben kann, bis ein definitiverer Eingriff durchgeführt werden kann.
Einige Babys mit TGA haben auch ein Loch zwischen den unteren Herzkammern, das als Ventrikelseptumdefekt bezeichnet wird. Wenn dieser vorhanden ist, kann es zu einer ausreichenden Vermischung des Blutes kommen, so dass das Baby gar nicht zyanotisch erscheint, sondern aufgrund des zusätzlichen Blutflusses in die Lunge tatsächlich an Symptomen einer Herzinsuffizienz erkrankt. Dann wird das Baby Symptome wie schlechte Ernährung, geringe Gewichtszunahme, Schwitzen und schnelle oder erschwerte Atmung zeigen.
Schließlich kann es zu einer Verengung des Bereichs kommen, der aus der linken Herzkammer zur Lungenarterie führt, was als Obstruktion des linken Ventrikelausflusswegs bezeichnet wird. In dieser Situation ist die gesamte Blutmenge, die in die Lunge fließt, reduziert, obwohl die Öffnung für das Blut vorhanden ist, um sich zu vermischen. Der Grad der Verengung variiert und kann anfangs leicht sein, aber mit der Zeit schlimmer werden. Mit zunehmender Verengung wird die Färbung des Babys zyanotischer (blau).
Die Schwere der Symptome hängt davon ab, wie viel rotes und blaues Blut sich miteinander vermischen und ob der Blutfluss aus der linken Herzkammer behindert ist oder nicht. Die Art und der Zeitpunkt der Operation hängen von der Kombination der Defekte ab, die das primäre Problem der TGA begleiten.
Babys mit TGA können eine frühe pulmonale Gefäßerkrankung entwickeln. Dabei handelt es sich um eine Erhöhung des Drucks in den Lungengefäßen, die Veränderungen verursachen, die es ihnen schwer machen, einen Blutfluss mit niedrigem Druck zu akzeptieren. Diese Veränderungen können schon in den ersten Lebenswochen auftreten und treten tendenziell häufiger bei Babys auf, die zusätzlich zur TGA einen Ventrikelseptumdefekt haben. Eine frühzeitige Korrekturoperation minimiert die Wahrscheinlichkeit der Entwicklung eines erhöhten pulmonalen Gefäßwiderstands bei diesen Babys.
Wie wird dieser Defekt diagnostiziert?
Klinische Merkmale: Wie oben beschrieben, haben Babys mit kompletter TOGA von Geburt an einen niedrigeren Sauerstoffgehalt im Blut. Die Blaufärbung ist an den Lippen und unter den Fingernagelbetten zu sehen und kann sehr schwer zu erkennen sein, wenn man das Baby nur ansieht. Es entwickeln sich Anzeichen von Stauungsinsuffizienz einschließlich der Symptome einer Herzinsuffizienz, einschließlich übermäßigem Schwitzen (ein kalter, klammer Schweiß, der oft während der Fütterung auftritt); schlechte Fütterung, langsame Gewichtszunahme, Reizbarkeit oder Lethargie und/oder schnelle Atmung entwickeln sich normalerweise während der Neugeborenenperiode.
Physikalische Befunde: Eine vollständige TOGA wird in der Regel 24 bis 48 Stunden nach der Geburt diagnostiziert, da eine Zyanose vorliegt, die in den meisten Fällen mittelschwer oder schwer ist. Das zweite Herzgeräusch ist laut und einzeln. Abhängig vom Vorhandensein eines Ventrikelseptumdefekts kann ein Herzgeräusch vorhanden sein oder nicht. Wenn sich das Baby in einer kongestiven Herzinsuffizienz befindet, ist die Atemfrequenz schnell und die Leber vergrößert.
Medizinische Tests: Der Sauerstoffgehalt des Blutes kann durch einen Sauerstoffsättigungstest oder durch eine Blutuntersuchung gemessen werden. Manchmal wird das Baby in ein Sauerstoffzelt gelegt und bekommt 100 % Sauerstoff zum Atmen, um zu sehen, ob die Blutsauerstoffwerte ansteigen. Wenn der Sauerstoffgehalt deutlich ansteigt, deutet dies darauf hin, dass der niedrige Sauerstoffgehalt von einem Lungenproblem und nicht von einem Herzproblem herrührt.
Ein Elektrokardiogramm und eine Röntgenaufnahme des Brustkorbs werden normalerweise ebenfalls durchgeführt. Der Defekt wird durch einen Herztest namens Echokardiogramm oder Herz-Ultraschall diagnostiziert. Das Echokardiogramm verwendet Schallwellen, um ein Bild von den Klappen und Kammern im Inneren des Herzens zu erstellen. Es ist sicher und schmerzlos und die Testergebnisse sind sofort verfügbar. In einigen Fällen wird die Diagnose bereits vor der Geburt während eines fetalen Ultraschalls gestellt. Der früheste Zeitpunkt, zu dem der Test zur Diagnose dieses Problems verwendet werden kann, ist, wenn die Mutter 18 Wochen in ihrer Schwangerschaft ist.
Ein weiterer Herztest, der Herzkatheterisierung genannt wird, ist notwendig, wenn das Echokardiogramm nicht völlig klar über das Herzproblem ist oder wenn zusätzliche Anomalien vorhanden sind, die beeinflussen können, wie der Chirurg den Defekt beheben würde. Bei diesem Verfahren werden Katheter (dünne Kunststoffschläuche) in die großen Blutgefäße in der Leistengegend eingeführt und vorsichtig in das Herz geführt. Dann wird Kontrastmittel oder „Farbstoff“ in das Herz gegeben, so dass Röntgenbilder gemacht werden können. Es werden auch Druckmessungen und Sauerstoffwerte ermittelt. Es ist aufwändiger als ein Echokardiogramm, gilt aber als sehr sicher. Die Babys werden während der Untersuchung sediert und erhalten Schmerzmittel. Die Ergebnisse liegen meist noch am selben Tag vor.
Kliniken
Pflege und Dienstleistungen für Patienten mit diesem Problem werden in den Kliniken für angeborenes Herz und kardiovaskuläre Chirurgie an der University of Michigan Health System in Ann Arbor angeboten.
Wie wird das Problem behandelt?
Behandlungen Teil 1 | Behandlungen Teil 2
Lupinetti FM, Bove EL, Snider AR, Callow LB, Meliones JN, Crowley DC, Beekman RH, Minich LL, Rosenthal A: Intermediate-term survival and functional results after arterial repair for transposition of the great arteries. J Thorac Cardiovasc Surg 1992;103:421-7.
Bove EL, Beekman RH, Snider AR, Rocchini AP, Dick M, Crowley DC, Serwer GS, Rosenthal A: Arterial repair for transposition and large ventricular septal defect in early infancy. Circulation l988;78 (Suppl III):III-26-III-3l.
Geschrieben von: Louise Callow RN, MSN (12/99)
Reviewed September, 2012