Objectifs
Après avoir terminé cette section, vous devriez être capable de
- écrire une équation pour décrire la formation d’une cyanhydrine à partir d’un aldéhyde ou d’une cétone.
- identifier la cyanhydrine formée à partir de la réaction d’un aldéhyde ou d’une cétone donnée avec le cyanure d’hydrogène.
- identifier l’aldéhyde ou la cétone, les réactifs, ou les deux, nécessaires à la préparation d’une cyanhydrine donnée.
- écrire le mécanisme détaillé de l’addition du cyanure d’hydrogène à un aldéhyde ou une cétone.
Termes clés
Veuillez vous assurer que vous pouvez définir, et utiliser en contexte, le terme clé ci-dessous.
- cyanohydrine
Notes d’étude
Pour réussir la formation de cyanohydrine, il est important d’avoir des ions cyanure libres disponibles pour réagir avec la cétone ou l’aldéhyde. Ceci peut être réalisé en utilisant un sel (par exemple KCN ou NaCN) ou une forme silylée (par exemple Me3SiCN) de cyanure dans des conditions acides ou en utilisant HCN avec une certaine base ajoutée pour produire le nucléophile CN- nécessaire.
Le cyanure d’hydrogène (HC≡N), s’ajoute de manière réversible aux aldéhydes et à de nombreuses cétones formant des adduits hydroxyalcanenitrile (communément connus et appelés cyanohydrines). Les cyanhydrines ont la formule structurelle suivante : R2C(OH)CN. Le « R » sur la formule représente un alkyle, un aryle ou un hydrogène.
Figure 19.6.1 : Réaction générale de formation de la cyanhydrine
Une caractéristique importante de la formation de la cyanhydrine est qu’elle nécessite un catalyseur basique. Le cyanure d’hydrogène étant lui-même un acide (pKa = 9,25), les meilleurs résultats se produisent lorsqu’une petite quantité d’une base forte active le cyanure d’hydrogène en le convertissant en ion cyanure ((-)C≡N), qui peut fonctionner comme un nucléophile du carbone. En l’absence de base, la réaction ne se produit pas, ou est au mieux très lente. La formation de la cyanohydrine est faiblement exothermique, et est favorisée pour les aldéhydes, et les cétones cycliques et méthyliques non encombrées.
Dans les synthèses pratiques de cyanohydrines, il est pratique d’ajouter un acide fort à un mélange de cyanure de sodium et du composé carbonyle, de sorte que le cyanure d’hydrogène soit généré in situ. La quantité d’acide ajoutée doit être insuffisante pour consommer tout l’ion cyanure, donc des conditions suffisamment alcalines sont maintenues pour une addition rapide.
De plus, l’hydrolyse catalysée par un acide de cyanhydrines silylées (R3SiCN) s’est avérée être une source de cyanure d’hydrogène pour former des cyanhydrines même avec des cétones fortement encombrées.
2 (CH3)3SiCN + H2O → (CH3)3SiOSi(CH3)3 + 2 HCN
Le cyanure d’hydrogène s’ajoute à travers la double liaison carbone-oxygène dans les aldéhydes et les cétones pour produire des composés connus sous le nom d’hydroxynitriles. Par exemple, avec l’éthanal (un aldéhyde), on obtient le 2-hydroxypropanenitrile:
Avec la propanone (une cétone), on obtient le 2-hydroxy-2-méthylpropanenitrile :
La réaction ne se fait normalement pas en utilisant le cyanure d’hydrogène lui-même, car c’est un gaz extrêmement toxique. On mélange plutôt l’aldéhyde ou la cétone avec une solution de cyanure de sodium ou de potassium dans de l’eau à laquelle on a ajouté un peu d’acide sulfurique. Le pH de la solution est ajusté à environ 4 ou 5, car c’est là que la réaction est la plus rapide. La solution contiendra du cyanure d’hydrogène (provenant de la réaction entre le cyanure de sodium ou de potassium et l’acide sulfurique), mais contient encore quelques ions cyanure libres. Ceci est important pour le mécanisme.
Mécanisme de formation de la cyanhydrine
1) Dans la première étape, l’ion cyanure agit comme un nucléophile et forme une liaison avec le carbone carbonyle électrophile. Les deux électrons de la liaison pi du carbonyle sont poussés sur l’oxygène électronégatif formant un intermédiaire ion alcoxyde tétraédrique.
2) L’ion alkoxyde est protoné par HCN qui a régénéré l’ion cyanure.
La chimie supplémentaire des cyanhydrines
Les groupes fonctionnels cyanhydrine s’avèrent souvent utiles en raison de la chimie supplémentaire qui peut être effectuée en raison de la présence d’une fonctionnalité hydroxyle et nitrile. En particulier, la déshydratation peut convertir le groupe hydroxyle en un alcène (section 17.6). Le nitrile peut être converti en un groupe fonctionnel acide carboxylique par réaction avec une solution aqueuse acide chaude (section 20.7). De même, le nitrile peut être réduit par l’addition de LiAlH4 pour former une amine primaire. La formation d’une cyanohydrine permet de transformer facilement les aldéhydes et les cétones en une grande variété de groupes fonctionnels.
Autres cyanhydrines
Les autres cyanhydrines intéressantes sont : le mandelonitrile, la cyanhydrine d’acétone et le glycolonitrile.
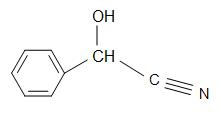

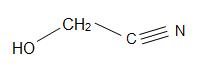
Structures du madelonitrile (à gauche), Acétone cyanohydrine (centre), et glycolonitrile (droite)
Le madelonitrile a une formule structurelle de C6H5CH(OH)CN et se trouvent dans les noyaux de certains fruits. L’acétone cyanohydrine a la structure, (CH3)2C(OH)CN, et est utilisée dans la production de méthacrylate de méthyle (également connu sous le nom d’acrylique). Le glycolonitrile est un composé organique dont la formule structurelle est HOCH2CN, qui est la cyanhydrine la plus simple dérivée des formaldéhydes.
Problèmes
Complétez les réactions suivantes pour les cyanhydrines :
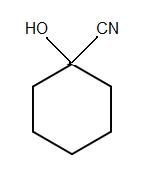
1)
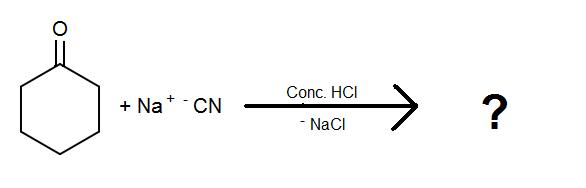
2)
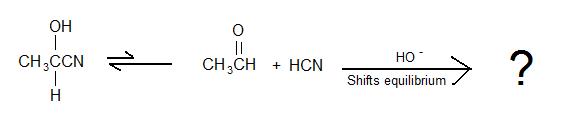
3) Vrai ou Faux : Pour qu’une cyanohydrine se forme, on réalise une additon rapide d’acide fort au sel de cyanure pour transformer le sel en HCN.
4) Vrai ou Faux : Les réactions de cyanhydrine sont irréversibles.
5) Quel est le produit de la réaction globale ?
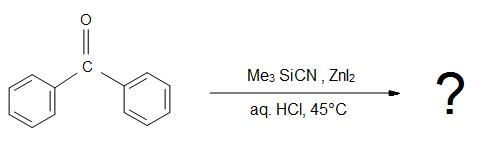
Réponses
1)
2)
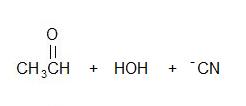
3) Faux, addition lente
4) Faux, réversible
5)
Contributeurs et attributions
-
Dr. Dietmar Kennepohl FCIC (professeur de chimie, Université Athabasca)
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, professeur émérite (Michigan State U.), Virtual Textbook of Organic Chemistry
-
Jim Clark (Chemguide.co.uk)