Le nitrure de calcium, appelé azanidylidène-calcium dans la nomenclature UICPA, est un composé inorganique dont les éléments constitutifs sont le calcium et l’azote et représenté par la formule chimique Ca3N2 . Il présente différentes formes isomorphes, parmi lesquelles le nitrure α-calcique est couramment rencontré .
Nitrure de calcium. Identification |
|
| Numéro CAS | 12013-82-0 |
| PubChem CID | 3387080 |
| ChemSpider ID | 21171155 |
| Numéro CE | 234-592-9 | Numéro RTECS | N/A |
| Clé InChI | XCNGEWCFFFJZJT-UHFFFAOYSA-N |
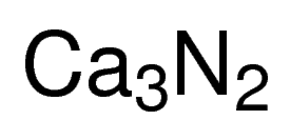
Formule du nitrure de calcium
.
Comment prépare-t-on le nitrure de calcium
Il peut être synthétisé lorsque le calcium est chauffé à une température élevée en présence d’air, ce qui est représenté par la réaction directe des éléments suivante :
3Ca + N2 → Ca3N2
Le nitrure de calcium formé peut être facilement identifié, car il réagit avec l’humidité ou l’eau pour produire de l’hydroxyde de calcium et de l’ammoniac :
Ca3N2 + 6H2O → 3Ca(OH)2 + 2NH3
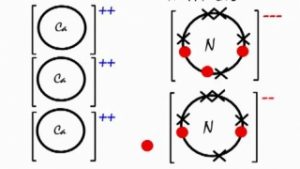
La liaison ionique du nitrure de calcium
Propriétés et caractéristiques du nitrure de calcium
Propriétés générales |
|
| Masse molaire/poids moléculaire | 148.248 g/mol |
Propriétés physiques |
| Couleur et apparence | Poudre cristalline rougeâtre-brun poudre cristalline |
| Point de fusion | 1,195 °C, 2 183 °F |
| Point d’ébullition | N/A | Densité | 2.63 g cm-3 |
| État de la matière à température ambiante (solide/liquide/gaz) | Solide |
| Solubilité | N/A |
| Solubilité dans l’eau | Décomposition dans H2O |
Propriétés atomiques |
|
| Structure cristalline | Cubique |
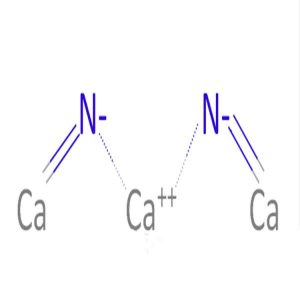
Structure chimique du nitrure de calcium
Utilisations
- Le Ca3N2 peut être utilisé pour obtenir des ions nitrure réactifs .
- L’hydrure de calcium (un dessiccant) peut être produit en chauffant le nitrure de calcium avec de l’hydrogène à des températures supérieures à 350 °C .
Est-il toxique
Le contact répété ou la surexposition au Ca3N2 a été lié à des lésions oculaires et des brûlures cutanées . C’est un solide inflammable et il faut le tenir éloigné des étincelles, de la chaleur, des flammes nues et de l’eau, en raison des réactions dangereuses possibles .
.