L’oxyde de chrome (iii), communément appelé chromie et appelé oxo(oxochromiooxy)chrome dans la nomenclature UICPA, est un composé inorganique contenant du chrome et de l’oxygène représenté par la formule chimique Cr2O3 . Il est présent à l’état naturel sous la forme du minéral eskolaite et est un composé très insoluble à haute stabilité thermique, ayant les propriétés à la fois d’un acide et d’une base .
Chromium (III) Oxyde Identification |
|
| Numéro CAS | 1308-38-9 |
| PubChem CID | 517277 |
| ChemSpider ID | 451305 |
| Numéro ONU | 3077 |
| Numéro CE | 215-160-9 | Numéro RTECS | GB6475000 |
| Clé InChI | QDOXWKRWXJOMAK-UHFFFAOYSA-N |
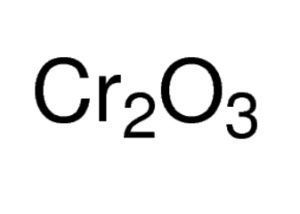
Formule de l’oxyde de chrome (III)
.
Comment prépare-t-on l’oxyde de chrome (III)
Il est produit par la réduction du dichromate de sodium à l’aide de soufre à des températures élevées indiquées par la réaction d’oxydoréduction :
Na2Cr2O7 + S → Na2SO4 + Cr2O3
Le dichromate d’ammonium, en chauffant, se décompose en oxyde de chrome (iii), en eau et en azote :
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
Le carbonate de chrome (iii) est chauffé pour former de l’oxyde de chrome (iii) et du dioxyde de carbone :
Cr2(CO3)3 → Cr2O3 + 3CO2
Réaction avec d’autres composés
L’oxyde de chrome (III) avec l’acide chlorhydrique
Il réagit avec l’acide chlorhydrique dilué pour former du chlorure de chrome (iii) et de l’eau :
Cr2O3 + 6HCl → 2CrCl3 + 3H2O
Oxyde de chrome (III) avec le sulfure d’hydrogène
Lorsque l’oxyde de chrome (iii) réagit avec le sulfure d’hydrogène gazeux, il donne du sulfure de chrome (iii) et de l’eau :
Cr2O3 + 3H2S → Cr2S3 + 3H2O
Propriétés et caractéristiques de l’oxyde de chrome (III)
Propriétés générales |
|
| Masse molaire/poids moléculaire | 151.989 g/mol |
Propriétés physiques |
| Couleur et apparence | Sèche, vert clair ou foncé, poudre cristalline fine |
| Point de fusion | 2,435 °C, 4,415 °F |
| Point d’ébullition | 4,000 °C, 7 230 °F |
| Densité | 5.22 g cm-3 |
| État de la matière à température ambiante | Solide. |
| Solubilité | Insoluble dans l’acétone et l’alcool, très légèrement soluble dans les alcalis et les acides |
| Solubilité dans l’eau | Pratiquement insoluble, 2.96 µg/L (20 °C, pH 8), 3,13 µg/L (20 °C, pH 6) |
| Susceptibilité magnétique (χ) | 1960.0 X 10-6 cm3/mol |
Propriétés atomiques |
|
| Structure cristalline | Hexagonale |

Oxyde de chrome (III)
Utilisations
- En raison de sa stabilité, l’oxyde de chrome (iii) est utilisé comme pigment vert dans les encres, les verres et les peintures et comme colorant pour les céramiques, ainsi que pour produire une légère teinte verte dans les glaçures .
- Il sert d’abrasif pour polir ou strier les bords des rasoirs, des couteaux et des surfaces des dispositifs optiques .
Est-il sûr
L’exposition à l’oxyde de chrome (iii) par la bouche et la peau peut provoquer une toxicité aiguë . Elle peut provoquer une réaction allergique de la peau et des lésions oculaires graves . Il peut également provoquer une toxicité pour la reproduction et est nocif pour l’enfant à naître .
- Oxyde de chrome (III) – Pubchem.ncbi.nlm.nih.gov
- Oxyde de chrome en poudre (Cr2O3) – Reade.com
- Oxyde de chrome(III) – Americanelements.com
- Chimie du chrome – Chem.libretexts.org
- Oxyde de chrome(III) – Chemspider.com
- Equations chimiques – Chemequations.com
- Stoichiometry of Ammonium Dichromate Decomposition – Dartmouth.edu
- Oxyde de chrome – Chromestarchemicals.com
- 5 faits intéressants sur l’oxyde de chrome vert – Basstechintl.com
.