 Le tableau périodique est organisé comme une grande grille. Chaque élément est placé à un endroit spécifique en raison de sa structure atomique. Comme toute grille, le tableau périodique comporte des lignes (de gauche à droite) et des colonnes (de haut en bas). Chaque ligne et chaque colonne ont des caractéristiques spécifiques. Par exemple, le magnésium (Mg) et le calcium (Mg) se trouvent dans la deuxième colonne et partagent certaines similitudes, tandis que le potassium (K) et le calcium (Ca) de la quatrième ligne ont des caractéristiques différentes. Le magnésium et le sodium (Na) partagent également des qualités car ils sont dans la même période (configurations électroniques similaires).
Le tableau périodique est organisé comme une grande grille. Chaque élément est placé à un endroit spécifique en raison de sa structure atomique. Comme toute grille, le tableau périodique comporte des lignes (de gauche à droite) et des colonnes (de haut en bas). Chaque ligne et chaque colonne ont des caractéristiques spécifiques. Par exemple, le magnésium (Mg) et le calcium (Mg) se trouvent dans la deuxième colonne et partagent certaines similitudes, tandis que le potassium (K) et le calcium (Ca) de la quatrième ligne ont des caractéristiques différentes. Le magnésium et le sodium (Na) partagent également des qualités car ils sont dans la même période (configurations électroniques similaires). 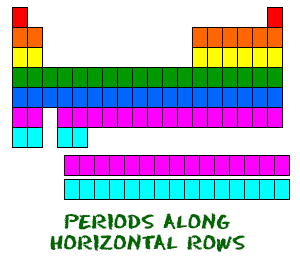 Même si elles sautent quelques carrés entre elles, toutes les rangées se lisent de gauche à droite. Lorsque vous regardez le tableau périodique, chaque rangée est appelée une période (vous comprenez ? comme le tableau périodique.). Tous les éléments d’une période ont le même nombre d’orbitales atomiques. Par exemple, chaque élément de la rangée supérieure (la première période) possède une orbitale pour ses électrons. Tous les éléments de la deuxième rangée (la deuxième période) ont deux orbitales pour leurs électrons. Au fur et à mesure que vous descendez dans le tableau, chaque rangée ajoute une orbitale. À l’heure actuelle, il y a un maximum de sept orbitales électroniques.
Même si elles sautent quelques carrés entre elles, toutes les rangées se lisent de gauche à droite. Lorsque vous regardez le tableau périodique, chaque rangée est appelée une période (vous comprenez ? comme le tableau périodique.). Tous les éléments d’une période ont le même nombre d’orbitales atomiques. Par exemple, chaque élément de la rangée supérieure (la première période) possède une orbitale pour ses électrons. Tous les éléments de la deuxième rangée (la deuxième période) ont deux orbitales pour leurs électrons. Au fur et à mesure que vous descendez dans le tableau, chaque rangée ajoute une orbitale. À l’heure actuelle, il y a un maximum de sept orbitales électroniques.
…et vos groupes
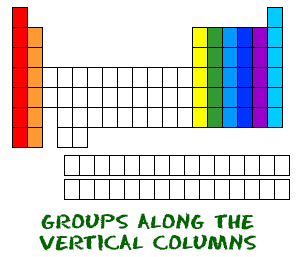 Vous connaissez maintenant les périodes allant de gauche à droite. Le tableau périodique a également un nom spécial pour ses colonnes verticales. Chaque colonne s’appelle un groupe. Les éléments de chaque groupe ont le même nombre d’électrons dans l’orbitale externe. Ces électrons extérieurs sont également appelés électrons de valence. Ce sont les électrons impliqués dans les liaisons chimiques avec les autres éléments.
Vous connaissez maintenant les périodes allant de gauche à droite. Le tableau périodique a également un nom spécial pour ses colonnes verticales. Chaque colonne s’appelle un groupe. Les éléments de chaque groupe ont le même nombre d’électrons dans l’orbitale externe. Ces électrons extérieurs sont également appelés électrons de valence. Ce sont les électrons impliqués dans les liaisons chimiques avec les autres éléments.
Chaque élément de la première colonne (groupe un) possède un électron dans son orbite externe. Chaque élément de la deuxième colonne (groupe deux) a deux électrons dans la coquille extérieure. En continuant à compter les colonnes, vous saurez combien d’électrons se trouvent dans la coquille extérieure. Il y a des exceptions à cet ordre lorsque tu regardes les éléments de transition, mais tu comprends l’idée générale. Les éléments de transition ajoutent des électrons à l’avant-dernière orbitale.
Par exemple, l’azote (N) a le numéro atomique sept. Le numéro atomique vous indique qu’il y a sept électrons dans un atome neutre d’azote. Combien d’électrons se trouvent dans son orbitale extérieure ? L’azote se trouve dans la quinzième colonne, intitulée « Groupe VA ». Le ‘V’ est le chiffre romain pour cinq et représente le nombre d’électrons dans l’orbitale externe. Toutes ces informations vous indiquent qu’il y a deux électrons dans la première orbitale et cinq dans la seconde (2-5).
Le phosphore (P) fait également partie du groupe VA, ce qui signifie qu’il possède également cinq électrons dans son orbitale externe. Cependant, comme le numéro atomique du phosphore est de quinze, la configuration électronique est 2-8-5.
Deux au sommet
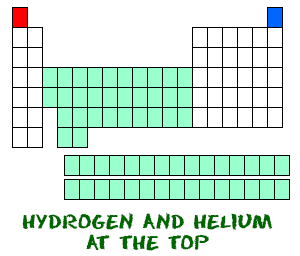 L’hydrogène (H) et l’hélium (He) sont des éléments particuliers. L’hydrogène, sous sa forme neutre, ne possède pas de neutron. Il n’y a qu’un électron et un proton. Vous ne trouverez probablement pas d’hydrogène atomique flottant tout seul. L’hydrogène atomique veut se combiner avec d’autres éléments pour remplir son enveloppe extérieure. Votre travail de chimie utilisera très probablement de l’hydrogène moléculaire (H2) ou des ions hydrogène (H+, protons).
L’hydrogène (H) et l’hélium (He) sont des éléments particuliers. L’hydrogène, sous sa forme neutre, ne possède pas de neutron. Il n’y a qu’un électron et un proton. Vous ne trouverez probablement pas d’hydrogène atomique flottant tout seul. L’hydrogène atomique veut se combiner avec d’autres éléments pour remplir son enveloppe extérieure. Votre travail de chimie utilisera très probablement de l’hydrogène moléculaire (H2) ou des ions hydrogène (H+, protons).
L’hélium (He) est différent de tous les autres éléments. Il est très stable avec seulement deux électrons dans son orbitale externe (coquille de valence). Même s’il n’a que deux électrons, il est toujours regroupé avec les gaz nobles qui ont huit électrons dans leurs orbitales extérieures. Les gaz nobles et l’hélium sont tous » heureux « , car leur coquille de valence est pleine.
Vidéo connexe…
Wikipedia : Tableau périodique
Encyclopedia.com : Tableau périodique