INTRODUCTION
Les virus sont des agents pathogènes particulièrement problématiques chez les transplantés, car la question des infections virales dans les transplantations reflète un équilibre complexe entre les différentes infections virales qu’un patient peut avoir tout au long de sa vie, la réponse immunitaire antivirale du receveur et le niveau d’immunosuppression nécessaire pour assurer le fonctionnement du greffon.
L’infection par le polyomavirus BK (BKV) est un problème émergent dans les transplantations rénales, et est considérée comme le prix à payer pour une immunosuppression (IS) moderne et puissante.
ASPECTS BIOLOGIQUES DU VIRUS
Le polyomavirus, avec le papillomavirus, appartient à la famille des papovavirus. Le virus BK (BKV) appartient à la famille des polyomavirus avec d’autres polyomavirus qui ont été détectés chez l’homme, comme le virus JC (JCV), le virus KI, le virus WU, le virus du carcinome des cellules de Merkel et le virus Simian 40 (SV40).
Ce sont de petits virus non enveloppés, d’un diamètre de 42 nm. La capside a une symétrie icosaédrique et abrite un génome à double chaîne circulaire d’ADN de plus de 5000 paires de bases, composé d’une région « précoce » qui est hautement conservée et code pour l’antigène « T/t » (TAg), qui est impliqué dans la transformation, la réplication virale, la régulation et l’expression des gènes ; et une région » tardive » qui code pour les trois protéines de capside, appelées VP1, VP2 et VP3, et pour une protéine appelée » agnoprotéine « , une région régulatrice non codante située entre les deux autres, où se trouvent les déterminants de la réplication, l’union TAg et les éléments de régulation transcriptionnelle.
Le polyomavirus possède une spécificité d’adaptation à son hôte ; par conséquent, son évolution est probablement associée à celle de l’espèce hôte, et l’infection naturelle ne se produit donc que chez un nombre limité d’espèces étroitement apparentées, constituant un marqueur pour établir les différences raciales entre les humains.
Utilisant l’analyse du séquençage génétique, différents génotypes ont été établis : Européen, asiatique et africain. Le reste des génotypes correspond à des recombinaisons de ces trois-là, et bien que son origine soit difficile à établir, l’étude de ce virus pourrait constituer un outil d’aide à la compréhension de l’évolution des migrations humaines.
Le BKV est associé à deux complications observées chez les transplantés : La néphropathie associée au virus BK (BKVN) chez les greffés rénaux, et la cystite hémorragique chez les greffés de moelle osseuse. Contrairement au BKV, bien que le JCV réside dans l’uroépithélium et se réactive normalement, il produit rarement une néphropathie, mais est associé à une leucoencéphalopathie multifocale et à une encéphalite. Le SV40, qui provient des simiens, a été introduit dans la population humaine par des vaccins contaminés par la polio et l’adénovirus, et bien que sa présence ait été détectée dans des biopsies de reins transplantés, son importance dans la transplantation rénale n’est pas encore bien définie.
Epidémiologie et facteurs de risque
La primo-infection survient de manière subclinique au cours de la première décennie de vie, avec une séroprévalence de plus de 80% dans la population adulte.
La source d’infection est exclusivement humaine, aucun animal n’a été démontré comme agissant en tant que réservoir, et la voie de transmission peut être fécale-orale, respiratoire, transplacentaire et par le biais de tissus donnés. Pendant la phase virémique, le virus infecte les tissus, l’urothélium, le tissu lymphatique et le cerveau, produisant une infection lytique latente.
Après la transmission virale naturelle pendant la petite enfance, le BKV reste dans les voies urinaires avec des réactivations intermittentes et de faibles niveaux de virurie (Vr), 5 % à 10 % chez les adultes immunocompétents1,2. Chez les personnes immunodéprimées, la fréquence de la Vr du BK augmente à 20 %-60 %, et des niveaux de virurie encore plus élevés ainsi que l’apparition de cellules leurres dans les urines sont également fréquents3.
Dans le cadre de la transplantation rénale, la prévalence des néphropathies associées au virus BK (BKVN) oscille entre 1 et 10 %,4 en fonction du traitement d’immunosuppression et des méthodes de diagnostic plus qu’en raison de réelles différences épidémiologiques.
En 2004, le traitement de l’infection par le BKV après une transplantation rénale a été inclus dans la base de données américaine en tant que variable de l’évolution post-transplantation (TBKV) ; les données ont ensuite été analysées, ce qui a permis d’obtenir un total de >48 000 transplantations, dont 1474 ont été traitées dans les 24 mois. L’incidence cumulée du TBKV a augmenté avec le temps, passant de 3,45% à 24 mois à 6,6% à 60 mois après la transplantation.
L’échec de la greffe secondaire au BKVN se produit à un taux de 50% à 100% à 24 mois dans les centres sans programme de dépistage, ce qui souligne l’importance d’un diagnostic précoce de la maladie5.
Différents protocoles d’IS ont été identifiés comme des facteurs de risque pour le développement du BKVN, en particulier l’utilisation de trithérapies avec des médicaments anticalcineuriniques, du mycophénolate mofétil (MMF) et des stéroïdes,5,6 mais des cas de BKVN ont également été décrits lors de l’utilisation d’autres régimes d’IS, ce qui indique que l’intensité du traitement d’IS, et non le médicament spécifique lui-même, est le facteur de risque dans ce cas. D’autres types de facteurs de risque existent également, comme les facteurs liés au patient (hommes >50 ans, receveur séronégatif pour le BKV), les facteurs liés au greffon (donneur séropositif pour le BKV, incompatibilités HLA, lésions immunologiques ou ischémiques) et les facteurs viraux (charge virale latente, sérotype de capside et capacité de réplication).7
Diagnostic HISTOLOGIQUE ET PROGRESSION DU BKVN
Les cellules décoïnes, la virurie et la virémie indiquent seulement une réplication virale, et non une néphropathie, mais elles sont des outils clés pour la prévention et le suivi de la maladie.
Le seul signe clinique du BKVN est la détérioration de la fonction rénale, et lorsque cela se produit, il est déjà trop tard pour intervenir, car les dommages rénaux ont déjà été produits.
Le diagnostic de la maladie ne peut être effectué qu’avec une biopsie du greffon dans laquelle on trouve les inclusions virales nucléaires basophiles typiques dans les cellules épithéliales (tubulaires, capsule de Bowman et/ou urothélium), et des signes d’inflammation avec tubulite (figure 1A), des résultats similaires à ceux qui apparaissent dans le rejet aigu de la greffe par les cellules T. Ce n’est qu’en utilisant la technique immunohistochimique pour SV-40 LTAg que l’on peut observer une coloration nucléaire positive et identifier le polyomavirus (BK, JC) comme étant celui responsable de l’inflammation, écartant ainsi le diagnostic de rejet aigu par les cellules T (figure 1B) et confirmant le diagnostic de BKVN.
Les lésions histologiques du BKVN sont focales et hétérogènes, de sorte qu’une biopsie négative ne peut exclure le diagnostic. A ce titre, ce test doit être répété si la charge virale dans le sang du patient reste durablement élevée.
Les schémas histologiques du BKVN2,8,9 sont basés sur l’identification et l’extension de l’infiltrat inflammatoire et de la fibrose associée à l’infection virale, ce qui permet d’établir trois schémas histologiques (figure 2).
ÉVOLUTION CLINIQUE ET POSSIBILITÉS DE PRÉVENTION ET DE DIAGNOSTIC PRÉCOCE
L’évolution clinique commune du BKVN9 est représentée dans la figure 3, qui montre comment le développement de la maladie est prédit par l’apparition de la virurie BK (BK Vr), une conséquence de la réactivation et de la réplication virale dans les voies urinaires, avec l’apparition de cellules leurres typiques (figure 4), qui sont faciles à identifier à l’aide de tests cytologiques urinaires de routine. Cependant, la quantification du Vr par des techniques de PCR est plus sensible que l’utilisation de la cytologie, et permet de distinguer les infections par le BKV et le JCV.
Lorsque la virurie est >105 copies/ml et qu’elle persiste, elle est suivie des semaines ou des mois plus tard par le développement d’une virémie (Vm) à >107 copies/ml et, finalement, par le BKVN. Le BK Vr ne permet pas de diagnostiquer une atteinte du parenchyme rénal, mais l’apparition simultanée du Vm et du Vr est pathognomonique d’une atteinte du parenchyme rénal (BKVN). Le maintien ou, plus typiquement, l’augmentation du Vm est un facteur prédictif de la détérioration de la fonction rénale, et est corrélé avec la présence et la gravité des lésions histologiques. Chez les patients dont la fonction rénale est normale ou modérément faible, la probabilité de trouver des indicateurs histologiques de BKVN est directement proportionnelle à la durée et à la gravité de la virémie. Une virémie élevée et soutenue permet d’identifier les patients présentant une réplication virale incontrôlée qui entraîne des lésions rénales.
En conclusion, un diagnostic et une intervention précoces minimisent les dommages causés au greffon. La figure 5 illustre un algorithme de diagnostic basé sur des publications antérieures4,9.
TRAITEMENT DU BKVN
Le meilleur traitement du BKVN est un diagnostic précoce de la maladie afin d’agir avant que des dommages rénaux ne soient causés.
Pour cette raison, les guides KDIGO10 suggèrent d’utiliser un processus de dépistage pour tous les patients transplantés rénaux en testant les niveaux de Vm mensuels pendant les 3 premiers mois (2D) et tous les trois mois jusqu’à la fin de la première année (2D), chaque fois qu’un dysfonctionnement rénal est produit sans cause alternative visible (2D), et après le traitement d’un épisode de rejet aigu (2D). Une réduction de l’IS est également suggérée lorsque le Vm est durablement supérieur à 107 copies/ml (2D).
En ce qui concerne la réduction de l’IS, la première étape consiste à mettre en œuvre le protocole standard (ne pas donner de CAN ou de traitements antiprolifératifs au-dessus des niveaux indiqués pour la marge thérapeutique), puis à mesurer la virémie toutes les 4 semaines, à réduire le NAb de 15 à 20 %, à réduire le MMF et/ou la suppression du MMF de 50 %, et/ou à remplacer le TAC par la CsA ou un ISP (Figure 6).11
En ce qui concerne les traitements antiviraux, les immunoglobulines i.v., le ciclofovir, le léflunomide et les quinolones ont été utilisés de manière empirique, et leur efficacité est actuellement difficile à déterminer car ils n’ont pas été administrés en combinaison avec une réduction de l’IS et en raison du manque d’études prospectives contrôlées et randomisées.
Enfin, nous aimerions commenter la retransplantation rénale chez les patients ayant perdu un greffon à cause du BKVN. La récurrence de la maladie dans les études courtes est de 12%. Les recommandations qui doivent être prises en compte dans ces situations sont les suivantes : 1) informer le patient quant au risque potentiel accru de récidive du BKVN ; 2) confirmer l’absence de réplication virale (PCR sanguine et urinaire lors de l’inscription du patient sur la liste de transplantation et tous les 6 mois par la suite), le patient doit recevoir la greffe avec des résultats négatifs de PCR sur les prélèvements sanguins, et 3) adapter le SI à la pathologie.12-14
PINTS CLÉS
1. Les formes puissantes et modernes d’immunosuppression pourraient être responsables de l’augmentation de la prévalence de cette infection
2. L’infection par le virus BK chez les patients immunodéprimés pourrait affecter la fonction et la survie des transplantations rénales
3. Un diagnostic précoce par une surveillance stricte du nombre de cellules décoïdes urinaires et/ou de la virurie et de la virémie est crucial pour éviter les impacts négatifs de cette complication
4. Il n’existe aucune preuve d’un traitement spécifique efficace de cette infection. Seule une réduction du traitement immunosuppresseur peut minimiser la virulence.
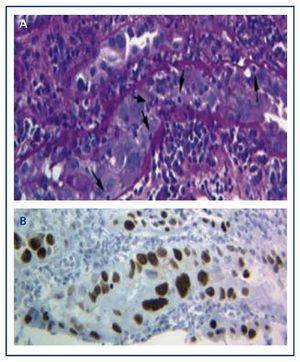
Figure 1. Inclusions virales nucléaires basophiles dans les cellules épithéliales et tubulite dans la néphropathie à virus BK (a) et immunohistochimie pour l’antigène SV-40 LTAg (b)

Figure 2. Schémas histologiques de la néphropathie associée au virus BK
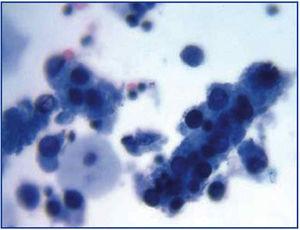
Figure 3. Cellules leurres dispersées et cylindres cellulaires contenant des cellules leurres compactées. Lorsqu’ils apparaissent, ces cylindres sont pathognomoniques d’une atteinte rénale
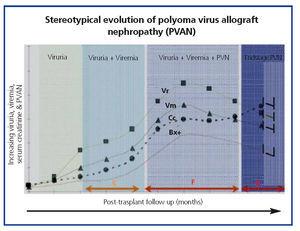
Figure 4. Phases d’évolution de la néphropathie associée au virus BK
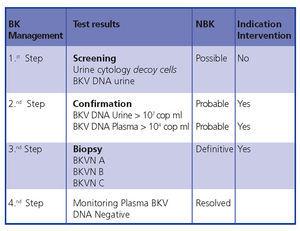
Figure 5. Algorithme de diagnostic du BKVN

Figure 6. Algorithme de traitement du BKVN
.