Introduction
La péricardiocentèse est la procédure thérapeutique la plus utile pour la gestion ou le diagnostic précoce d’un épanchement péricardique important et symptomatique et d’une tamponnade cardiaque. La première description de la décompression cardiaque remonte à 1653, lorsque Riolanus a suggéré une trépanation sternale pour soulager la pression péricardique. En 1911, Marfan a décrit pour la première fois l’approche sous-xiphoïdienne, qui était utilisée pour la procédure de péricardiocentèse en aveugle depuis des décennies, malgré des taux de morbidité et de mortalité importants (50 % et 6 %, respectivement). Au cours des années suivantes, les techniques recommandées pour une péricardiocentèse sûre et réussie ont considérablement évolué, notamment avec l’introduction du guidage fluoroscopique, électrocardiographique et, enfin, échocardiographique, et avec la description d’approches autres que l’approche substernale (apicale et parasternale).
Tamponade cardiaque
La tamponnade cardiaque est une compression lente ou rapide du cœur, mettant en danger la vie du patient, due à une augmentation du liquide péricardique. Le péricarde peut s’étirer pour accueillir l’accumulation de liquide, mais lorsque la compliance péricardique ne peut plus augmenter, une égalisation des pressions intrapéricardiques (veine centrale, chambres cardiaques droite et gauche) se produit, généralement autour de 15-20 mmHg. À ce stade, le ventricule droit s’affaisse et l’hypotension devient sévère. L’effet hémodynamique d’un épanchement péricardique important est un continuum car une faible augmentation du contenu péricardique couple le péricarde au cœur, augmentant significativement l’interaction auriculaire et surtout ventriculaire. De tels phénomènes exagèrent les effets respiratoires réciproques normaux sur les côtés droit et gauche du cœur. Dans les premiers stades de l’atteinte hémodynamique de l’épanchement péricardique, les patients peuvent ne présenter que des signes échocardiographiques de compression des cavités cardiaques (collapsus auriculaire droit et gauche, collapsus du ventricule droit, cœur oscillant, mouvement du septum interventriculaire vers la gauche, congestion de la veine cave inférieure) sans signes et symptômes cliniques (tamponnade subclinique). Dans ces cas, les résultats échocardiographiques peuvent être trop sensibles et surdiagnostiquer une tamponnade cardiaque chez des patients ne présentant que des signes subtils d’atteinte hémodynamique. Par conséquent, la tamponnade échocardiographique n’est pas une indication claire de la péricardiocentèse.
Cliniquement, la tamponnade cardiaque est définie comme la phase décompensée de la compression cardiaque, résultant d’une augmentation de la pression intrapéricardique. Les symptômes et signes cliniques comprennent une dyspnée, une pression veineuse jugulaire élevée, une hypotension, une tachycardie et un pulsus paradoxus. Au moins un de ces signes est présent dans plus de 75% des cas.
Effet de la péricardiocentèse
L’effet de la péricardiocentèse est souvent immédiat : le drainage de quelques millilitres de l’épanchement augmente significativement le volume systolique, réduit les pressions intrapéricardique et auriculaire, et permet de séparer les pressions de remplissage droite et gauche. La tachycardie et la dyspnée diminuent, tandis que la pression artérielle augmente et que le pulsus paradoxus disparaît.
Indications de la péricardiocentèse
Chez les patients hémodynamiquement instables, une procédure urgente est obligatoire car seule l’élimination du liquide permet un remplissage ventriculaire normal et rétablit un débit cardiaque adéquat. Sinon, la procédure pourrait être réalisée dans les heures suivant la présentation et le guidage visuel et l’approche la plus appropriée pourraient être planifiés. Un indice de cotation a récemment été proposé chez les patients présentant une suspicion de tamponnade pour décider s’il faut effectuer une péricardiocentèse urgente ou un drainage dans les heures qui suivent. Il se compose de trois éléments obtenus lors de la présentation initiale : étiologie, présentation clinique et résultats échocardiographiques.
En cas d’épanchement péricardique sans compromission hémodynamique, la péricardiocentèse est indiquée en cas d’épanchement symptomatique modéré à important ne répondant pas au traitement médical, ou en cas d’épanchement plus petit, lorsqu’une péricardite tuberculeuse, bactérienne ou néoplasique est suspectée, ou en cas d’épanchement péricardique chronique (durant plus de trois mois) et important (>20 mm à l’échocardiographie en diastole).
La péricardiocentèse à des fins diagnostiques n’est pas justifiée en cas d’épanchement léger ou modéré (<20 mm) pour les raisons suivantes : 1) faible pouvoir diagnostique (la pathologie sous-jacente est souvent déjà connue ou identifiable par différents tests non invasifs) ; 2) la péricardite virale (idiopathique) est généralement autolimitée et ne nécessite qu’un traitement anti-inflammatoire ; et 3) risque procédural élevé par rapport au faible rendement diagnostique.
Contraindications
Il n’y a pas de contre-indication absolue à la péricardiocentèse en cas de tamponnade cardiaque et de choc. La dissection aortique et la rupture post-infarctus de la paroi libre sont des contre-indications à la péricardiocentèse à l’aiguille (tamponnade chirurgicale) en raison du risque potentiel d’aggraver la dissection ou la rupture myocardique par une décompression péricardique rapide et la restauration de la pression artérielle systémique. Cependant, si la prise en charge chirurgicale n’est pas immédiatement disponible, ou si le patient est trop instable, la péricardiocentèse et le drainage de très petites quantités d’hémopéricarde peuvent être tentés afin de maintenir la pression artérielle à environ 90 mmHg en attendant la chirurgie d’urgence. Les contre-indications relatives sont une coagulopathie non corrigée, un traitement anticoagulant, une thrombocytopénie (PLTc <50 000/mm3).
Approches
Technique guidée par fluoroscopie
L’approche fluoroscopique a été le premier système d’imagerie utilisé pour la péricardiocentèse percutanée. Elle est réalisée par l’approche sous-xiphoïdienne avec une aiguille contenant un produit de contraste, dirigée vers l’épaule gauche à un angle de 30° par rapport à la peau. La position de l’aiguille dans l’espace péricardique est confirmée par l’injection du produit de contraste : l’apparition en position inférieure d’une couche lente du produit de contraste indique que la position est correcte et qu’un fil-guide souple à pointe en J peut être introduit. Il est essentiel de vérifier la position du fil-guide dans au moins deux projections angiographiques (vue latérale et vue antérieure-postérieure).
Cette procédure est standardisée et efficace, mais elle ne peut être réalisée que dans les laboratoires de cathétérisme cardiaque et elle implique une exposition aux radiations pour le patient et le médecin. Cependant, cette procédure pourrait être très utile pour traiter la tamponnade iatrogène lors des procédures percutanées. Un examen échocardiographique pour évaluer la distribution et la quantité de l’épanchement péricardique devrait toujours précéder la procédure guidée par fluoroscopie, dans la mesure du possible.
Technique guidée par tomographie assistée par ordinateur
Ces dernières années, des preuves de la faisabilité de la péricardiocentèse sous guidage par tomographie assistée par ordinateur (CT) ont été rapportées. Grâce au scanner de planification, l’extension complète de l’épanchement péricardique est évaluée et le point d’entrée optimal est défini et marqué sur la peau. Ensuite, l’aiguille est avancée dans l’épanchement péricardique et une seule tomographie est utilisée pour vérifier la position de l’aiguille. Cette technique ne permet pas une visualisation continue de l’aiguille et implique une exposition significative aux radiations pour le patient. En outre, elle n’est pas largement disponible, n’est pas faisable d’un point de vue logistique et prend beaucoup de temps (durée médiane de 65 minutes). Cependant, elle peut être utilisée avec succès chez les patients ayant une mauvaise fenêtre échographique et peut montrer très efficacement l’épanchement localisé, ce qui permet d’identifier le meilleur site d’entrée. De plus, le scanner permet de mesurer la densité de l’épanchement péricardique, évitant ainsi l’échec de la procédure en cas d’épanchements très visqueux, tels que les épanchements purulents et les hématomes intrapéricardiques. Enfin, le scanner permet d’évaluer l’ensemble du thorax et de détecter les anomalies associées, ce qui est utile pour identifier la maladie sous-jacente.
Technique échoguidée
La péricardiocentèse guidée par échocardiographie est une technique sûre et simple, introduite à la Mayo Clinic en 1979 et largement utilisée de nos jours. L’approche guidée par échocardiographie permet de définir la position de l’épanchement, le site d’entrée idéal et la trajectoire de l’aiguille pour la péricardiocentèse. Il existe deux approches différentes de l’échoguidage : la première (décrite par la Mayo Clinic) est la méthode écho-assistée, dans laquelle l’opérateur mémorise la trajectoire optimale de l’aiguille et avance l’aiguille vers l’espace péricardique sans visualisation échographique continue. La deuxième approche est la méthode échoguidée avec une surveillance échocardiographique continue. Il a également été proposé d’utiliser un porte-aiguille monté sur le transducteur échographique pour faire avancer l’aiguille vers l’espace péricardique.
Site de ponction
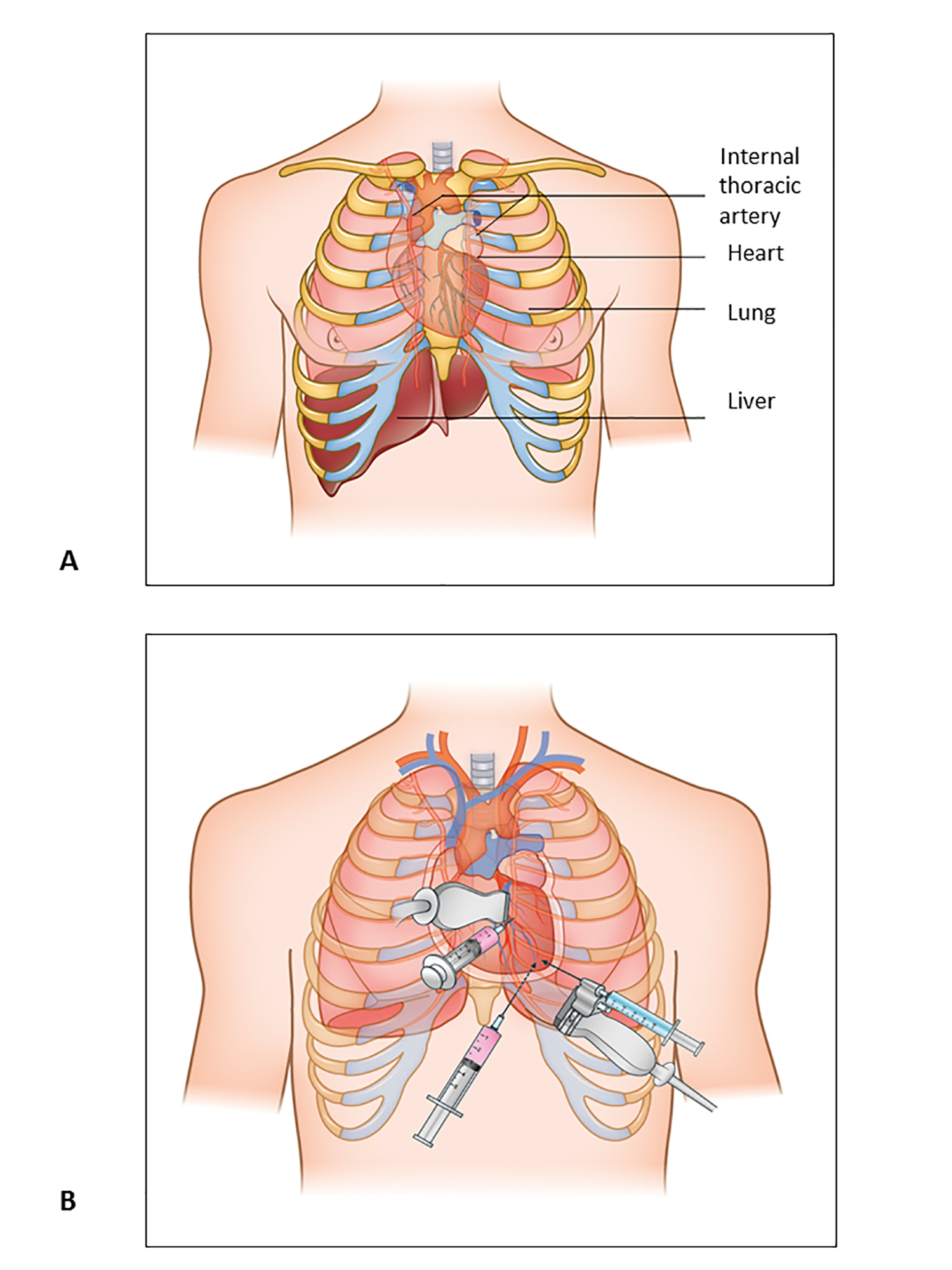
Trois approches principales peuvent être utilisées pour la péricardiocentèse : l’approche apicale, l’approche sous-costale ou l’approche parasternale.
Traditionnellement, une approche sous-costale a été préférée, en grande partie parce qu’elle était considérée comme la voie la plus sûre sans guidage par image. Cependant, l’épanchement péricardique n’est pas toujours circonférentiel et également réparti ; par conséquent, une évaluation échographique du site d’entrée idéal pour le drainage est fondamentale pour le succès de la procédure. La Mayo Clinic recommande de choisir l’approche en se basant uniquement sur les résultats échocardiographiques et définit le site d’entrée optimal comme le point où l’espace péricardique est le plus proche de la sonde et où l’accumulation de liquide est maximale, sans organes vitaux intermédiaires. Ce site est plus souvent para-apical que sous-costal. De plus, une série d’observation sur la péricardiocentèse échoguidée a démontré un plus grand taux de réussite et un taux de complication mineur lorsque le site d’entrée était sélectionné par échocardiographie plutôt que lorsque l’approche sous-xiphoïdienne était systématiquement utilisée (tableau 1, figure 1). .
Tableau 1. Caractéristiques des différentes approches de péricardiocentèse
|
Lieu de ponction |
Description |
Inconvénients |
Avantages |
|---|---|---|---|
|
Apical |
Le site d’insertion de l’aiguille est situé à 1-2 cm latéralement au battement de l’apex dans le cinquième, sixième ou septième espace intercostal. Avancer l’aiguille sur le bord supérieur de la côte pour éviter les nerfs et les vaisseaux intercostaux. |
Risque de ponction ventriculaire en raison de la proximité du ventricule gauche. Risque accru de pneumothorax pour la proximité de l’espace pleural gauche. |
La paroi plus épaisse du ventricule gauche est plus susceptible de s’auto-sceller après la ponction. Du fait que les ultrasons ne pénètrent pas l’air, l’utilisation du guidage échocardiographique permet d’éviter le poumon. Le chemin pour atteindre le péricarde est plus court. |
|
Parasternale |
Le site d’insertion de l’aiguille se situe dans le cinquième espace intercostal gauche, près de la marge sternale. Avancer l’aiguille perpendiculairement à la peau (au niveau de l’échancrure cardiaque du poumon gauche). |
Risque de pneumothorax et de ponction des vaisseaux thoraciques internes (si l’aiguille est insérée à plus de 1 cm latéralement). |
Le guidage échocardiographique, également avec sonde à réseau de phase, permet une bonne visualisation des structures péricardiques. |
Subxiphoïde |
Le site d’insertion de l’aiguille se situe entre le xiphisternum et le rebord costal gauche. Une fois sous la cage cartilagineuse, abaissez l’aiguille selon un angle de 15 à 30 degrés, la paroi abdominale étant dirigée vers l’épaule gauche. |
Un angle plus raide peut pénétrer dans la cavité péritonéale, et une direction médiane augmente le risque de ponction de l’oreillette droite. Dans certains cas, le lobe hépatique gauche peut être traversé intentionnellement si un site alternatif n’est pas disponible. Le chemin pour atteindre le fluide est plus long. |
Plus faible risque de pneumothorax. |
Figure 1. Péricardiocentèse : Structures anatomiques et approches.
A) Structures anatomiques à garder à l’esprit pendant la procédure de péricardiocentèse.
B) Trois approches principales pour la péricardiocentèse, parasternale, substernale et apicale.
Aspects techniques de la procédure échoguidée
Une liste de matériel est fournie dans le tableau 2.
Tableau 2. Équipement requis pour réaliser une péricardiocentèse échoguidée avec ou sans système d’aiguille monté sur sonde.
Équipement pour la péricardiocentèse échoguidée
Échocardiographie avec une sonde cardiaque
Couvercle de sonde stérile et gel d’écho stérile
Jauge 16-18, Aiguille gainée de téflon
Dilatateur et gaine d’introduction de 6 Fr à 8 Fr
Fil-guide à extrémité en J
Cathéter de drainage : angiocathéter en queue de cochon 6 Fr à 8 Fr ou set de drainage péricardique spécifique
Système de rinçage jetable pour maintenir la perméabilité du cathéter
Équipement pour la procédure monitorée par échographie en temps réel.temps réel
Support multi-angle à monter sur l’échosonde
Kit stérile de guide aiguille
Jauge 18, Aiguille de 9 cm (ou 15 cm pour l’approche sous-xiphoïdienne)
Dilatateur de 6 Fr à 8 Fr
La préparation préalable est essentielle pour la réalisation sûre de la péricardiocentèse. La numération plaquettaire et le profil de coagulation doivent être vérifiés. Des unités de globules rouges conditionnées doivent être facilement disponibles avant de commencer les procédures non urgentes. Une surveillance électrocardiographique du patient est nécessaire dans un environnement approprié avec un équipement de réanimation. Un cathéter veineux central est essentiel pour surveiller la pression de l’oreillette droite et permettre la perfusion rapide de liquides et de médicaments si cela est indiqué. La surveillance continue de la pression artérielle est indiquée pour détecter la présence d’un pulsus paradoxus et pour détecter et corriger rapidement une instabilité hémodynamique soudaine.
Une évaluation échocardiographique préliminaire est recommandée avec différentes vues pour évaluer la taille et la distribution de l’épanchement, pour sélectionner le site d’entrée approprié et aussi pour surveiller la procédure. Le patient doit être placé en position semi-allongée avec un angle d’environ 30° et légèrement tourné vers la gauche pour favoriser la collecte du liquide dans la partie inféro-antérieure du thorax. Après une désinfection appropriée du champ opératoire, un anesthésique local est administré au site de ponction. La trajectoire de l’aiguille est définie par l’angle entre la sonde et la paroi thoracique. L’opérateur doit visualiser la trajectoire optimale de l’aiguille, puis faire avancer une aiguille de calibre 16-18, gainée de téflon et munie d’une seringue remplie de sérum physiologique, en direction de l’espace rempli de liquide. Lorsque le liquide est aspiré, l’aiguille doit être avancée d’environ 2 mm de plus. La gaine doit être avancée sur l’aiguille et le noyau d’acier doit être retiré, en maintenant uniquement la gaine dans l’espace péricardique. Un fil-guide doit être avancé à travers la gaine, qui peut ensuite être retirée. Une aspiration sanglante peut indiquer une ponction myocardique ou un épanchement péricardique hémorragique. La position extracardiaque de la pointe peut être confirmée par l’injection de 5 ml de solution saline agitée en perfusion : les bulles peuvent être visualisées par échocardiographie dans l’espace péricardique. Une petite incision doit être pratiquée au niveau du site d’entrée, suivie de l’introduction d’un dilatateur gainé (6 Fr à 8 Fr) sur le guide. Le dilatateur doit être retiré et un cathéter en queue de cochon doit être inséré directement dans la gaine. L’épanchement péricardique est aspiré par une seringue et le cathéter est fermé après rinçage avec 5 ml de sérum physiologique hépariné.
Une autre approche utilise un porte-aiguille monté sur le transducteur pour faire avancer l’aiguille sous visualisation continue (procédure en temps réel, surveillée par l’écho). Dans la plupart des cas, la procédure est réalisée par deux médecins – un qui effectue l’échocardiogramme et un autre qui effectue la ponction et le drainage – Figure 2.
Figure 2. Procédure de péricardiocentèse échoguidée.
Placez le patient en position semi-allongée (panneau A), utilisez une aiguille montée sur sonde recouverte d’une gaine stérile (panneau B), choisissez l’angle approprié pour l’aiguille (panneaux C et D), avancez lentement l’aiguille en aspiration dans le tissu jusqu’à ce qu’il y ait une visualisation continue de la pointe (flèche noire) (panneau E), introduisez un fil à pointe en J dans l’aiguille sous visualisation continue (flèche noire) (panneau F).
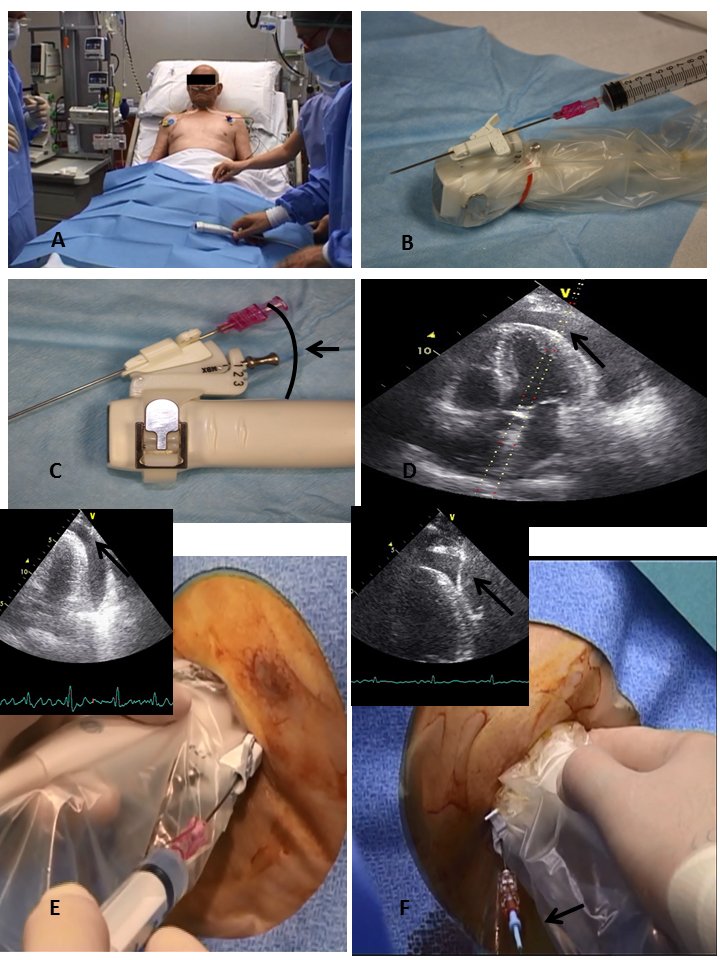
La préparation du patient est la même que celle décrite ci-dessus. Le support doit être monté sur la sonde pour supporter le kit guide-aiguille. Le support supporte l’aiguille avec différents angles et l’opérateur peut choisir entre un angle plus proche ou plus large. La sonde doit être recouverte d’une gaine stérile et le kit guide-aiguille doit être monté sur la sonde gainée.
Une fois que le placement et la direction de l’aiguille sont choisis, une aiguille de calibre 16-18 et de 9 cm est connectée à une seringue et est lentement avancée en aspiration à travers le tissu jusqu’à ce qu’il y ait une visualisation continue de la pointe. Lorsque l’épanchement péricardique est atteint et que le placement est confirmé par échocardiographie, un fil à pointe en J est introduit dans l’espace péricardique sous visualisation continue et un cathéter en queue de cochon doit être inséré selon la technique de Seldinger.
Gestion post-intervention
L’aspiration est répétée toutes les quatre à six heures et le cathéter peut être retiré lorsque le drainage a diminué à moins de 25 à 30 ml en 24 heures. Les soins du cathéter péricardique sont les mêmes que ceux du cathéter veineux central. Après l’intervention, tous les patients subissent une radiographie pulmonaire pour exclure la présence d’un pneumothorax.
Gestion médicale
La gestion médicale n’est qu’une mesure temporaire pour les patients souffrant de tamponnade en attendant la péricardiocentèse.
Les patients hypotendus (pression artérielle systolique <100 mmHg) avec une hypovolémie peuvent être traités avec un faible volume (250-500 ml) de sérum physiologique car il a été démontré que cela améliore les paramètres hémodynamiques. Cependant, la perfusion de volumes plus importants peut augmenter la pression cunéiforme et la pression intrapéricardique, et réduire le débit cardiaque. L’administration intraveineuse de diurétiques est contre-indiquée et pourrait être fatale chez les patients à la limite de leur mécanisme compensatoire en cas de tamponnade. La dopamine et la dobutamine améliorent toutes deux l’hémodynamique : la dobutamine a une plus grande activité bêta et, par conséquent, elle peut être préférable. Cependant, l’utilité des inotropes est généralement limitée car la stimulation adrénergique endogène est déjà accrue en cas de tamponnade. Une prophylaxie antibiotique n’est pas indiquée, sauf si l’intervention a été réalisée en urgence sans asepsie adéquate.
Complications
Le taux de complications majeures rapporté dans de grandes études observationnelles pour la péricardiocentèse échoguidée ou fluoroscopique est de 0,3 à 3,9%, et le taux de complications mineures est de 0,4 à 20%.
Les complications les plus graves comprennent le décès, la lésion des cavités cardiaques, la lacération des artères coronaires ou des vaisseaux intercostaux, la ponction des viscères abdominaux ou de la cavité péritonéale, le pneumothorax nécessitant la pose d’un drain thoracique, le pneumopéricarde, les arythmies ventriculaires et le syndrome de décompression péricardique. La ponction myocardique et coronaire peut initialement être silencieuse et se présenter avec un hémopéricarde retardé ou un thrombus intrapéricardique.
La décompression péricardique est un syndrome rare, potentiellement mortel, caractérisé par des scénarios cliniques larges (de l’œdème pulmonaire au choc cardiogénique). Il se développe généralement après un drainage péricardique réussi, de quelques heures à quelques jours plus tard. Le mécanisme de cette situation n’est pas encore bien compris. Cependant, l’explication la plus simple est une surcharge aiguë du ventricule gauche due à une augmentation de la précharge du côté droit associée à une vasoconstriction périphérique catécholaminergique persistante. A ce jour, il n’existe pas de recommandations efficaces pour prévenir ce syndrome, si ce n’est de retirer suffisamment de liquide pour normaliser la pression artérielle veineuse centrale et systémique (pas >1 L) et de compléter le retrait dans les quelques heures qui suivent.
Les complications mineures comprennent une hypotension vasovagale et une bradycardie transitoires, des arythmies supraventriculaires, un pneumothorax sans instabilité hémodynamique et des fistules pleuro-péricardiques.
Plusieurs auteurs ont suggéré qu’une attention particulière doit être accordée à la gestion périprocédurale du traitement anticoagulant et proposent qu’en présence de troubles sévères de la coagulation, la péricardiocentèse soit reportée jusqu’à ce qu’une transfusion sanguine suffisante ou un autre traitement hématologique approprié soit fourni si une tamponnade manifeste n’est pas présente. Dans le cadre d’un épanchement péricardique iatrogène, l’anticoagulation complète est considérée comme un facteur de risque majeur tant pour la tamponnade que pour ses séquelles.
Les perles et les pièges
Gestion respiratoire
La ventilation spontanée versus mécanique et les niveaux de PaCO2 influencent significativement l’évolution de la tamponnade péricardique. La pression péricardique diminue de 3 à 6 mmHg lorsque la PaCO2 descend à 24 mmHg ; à l’inverse, les pressions péricardiques augmentent de 2 à 4 mmHg lorsque la PaCO2 atteint 57 mmHg. L’augmentation des pressions intrathoraciques pendant la phase inspiratoire de la ventilation mécanique peut diminuer le débit cardiaque jusqu’à 25 % chez les patients présentant une tamponnade. Les patients présentant une suspicion de tamponnade cardiaque ne doivent donc pas recevoir de ventilation à pression positive, sauf en cas de nécessité absolue, afin d’éviter tout compromis hémodynamique supplémentaire.
Soins de drainage par cathéter
L’occlusion du cathéter peut survenir dans jusqu’à 10% des cas. Afin d’optimiser la perméabilité du cathéter, il pourrait être utile de réaliser une aspiration intermittente toutes les six heures et d’utiliser un système de rinçage continu jetable entre les aspirations. Une longue période de perméabilité du cathéter et une manipulation limitée au retrait de l’épanchement sont autorisées, réduisant ainsi les chances de contamination du liquide péricardique.
Prévention de la tamponnade cardiaque
Le drainage péricardique pendant 24 à 72 heures est suffisant pour éviter la récidive de la tamponnade péricardique dans la majorité des cas. Le taux de récidive après la procédure initiale est de 27 à 55% pour les patients qui subissent une péricardiocentèse simple, et de 12 à 24% pour ceux qui ont un drainage prolongé. L’omission d’un drainage prolongé par cathéter est un facteur prédictif indépendant important de récidive. Il est important de vider le sac péricardique aussi complètement que possible, en laissant le cathéter en place jusqu’à 72 heures ou plus si le fluide a un taux d’accumulation supérieur à 30 ml en 24 heures. Les complications associées à l’utilisation d’un cathéter péricardique sont rares. Un seul cas de bactériémie a été rapporté sur 781 cas dans lesquels cette méthode a été utilisée. La ré-accumulation de liquide péricardique est fréquente chez les patients présentant des épanchements péricardiques malins. Chez ces patients, plusieurs procédures ont été proposées pour prévenir la récurrence de la tamponnade. Ces approches comprennent la répétition de la péricardiocentèse, qui est probablement la procédure de choix chez les patients en phase terminale de la maladie, la sclérose intrapéricardique, la chimiothérapie systémique, la radiothérapie, l’intervention chirurgicale ou la péricardiotomie percutanée par ballonnet.
Faux négatifs et faux positifs échocardiographiques
Le déterminant échocardiographique faux positif le plus fréquent de la tamponnade est le collapsus auriculaire droit. Ce signe, ainsi que le collapsus diastolique du ventricule droit, peut être mis en évidence chez les patients en déplétion volumique. Dans ce contexte, la pression intrapéricardique est au moins égale aux pressions auriculaire et ventriculaire droites, qui sont diminuées en raison de la faible précharge. De plus, un épanchement pleural important peut entraîner une augmentation de la pression intrapéricardique, suffisante pour provoquer des résultats échocardiographiques de tamponnade cardiaque. Dans cette situation, l’approche thérapeutique appropriée est le drainage de l’épanchement pleural. En revanche, chez les patients présentant des pressions élevées du côté droit attribuables à une hypertension pulmonaire, une embolie pulmonaire ou une surcharge volumique du ventricule droit, la tamponnade cardiaque ne montrera pas de collapsus auriculaire ou ventriculaire droit. La raison de ce phénomène est une pression intrapéricardique élevée qui n’égalise pas la pression du ventricule droit ou de l’oreillette droite.
Effusion hémorragique
Des résultats faussement négatifs de la péricardiocentèse sont obtenus dans 20 à 40 % des cas d’effusion hémorragique, même lorsque la ponction péricardique peut être effectuée sans délai. Les résultats faussement négatifs peuvent être causés par la formation rapide de caillots, qui empêchent l’aspiration du sang. Par conséquent, l’échec de l’aspiration du sang en cas de lésion thoracique traumatique ne doit pas exclure le diagnostic possible d’épanchement hémorragique, retardant ainsi l’évacuation. Dans ces cas, la visualisation de l’aiguille dans l’espace péricardique permet de confirmer l’atteinte de l’espace, évitant ainsi des ponctions répétées.
Effets sur le pronostic
La péricardiocentèse est une manœuvre de sauvetage en cas de tamponnade cardiaque avec atteinte hémodynamique sévère et doit être réalisée en urgence. Il n’existe pas d’études randomisées dans ce contexte. Une fois la péricardiocentèse effectuée, le pronostic dépend de la maladie sous-jacente, étant mauvais en cas d’étiologie néoplasique et excellent en cas de péricardite idiopathique/virale. Chez les patients présentant un épanchement péricardique sans tamponnade mais suspects de péricardite tuberculeuse, bactérienne ou néoplasique, la péricardiocentèse est obligatoire car un diagnostic correct par l’analyse du liquide péricardique permet une thérapie appropriée et réduit la probabilité d’une évolution vers une péricardite constrictive. En cas d’épanchement péricardique chronique important, le pronostic est généralement bon, mais il peut y avoir un risque d’évolution vers une tamponnade cardiaque de 35%.
Conclusion
La péricardiocentèse peut être une procédure potentiellement salvatrice qui comporte un risque élevé de complications. À cet égard, le soutien de l’imagerie et la planification minutieuse du site d’entrée adéquat sont fondamentaux pour une procédure sûre et réussie.
Il s’agit d’une procédure d’une grande importance.