VIVO Physiopathologie
Sécrétions exocrines du pancréas
Le suc pancréatique est composé de deux produits de sécrétion essentiels à une bonne digestion : les enzymes digestives et le bicarbonate. Les enzymes sont synthétisées et sécrétées par les cellules acineuses exocrines, tandis que le bicarbonate est sécrété par les cellules épithéliales qui tapissent les petits canaux pancréatiques.
Enzymes digestives
Le pancréas sécrète une magnifique batterie d’enzymes qui ont collectivement la capacité de réduire pratiquement toutes les macromolécules digestibles en des formes capables, ou presque, d’être absorbées. Trois grands groupes d’enzymes sont essentiels à une digestion efficace :
1. Les protéases
La digestion des protéines est initiée par la pepsine dans l’estomac, mais l’essentiel de la digestion des protéines est dû aux protéases pancréatiques. Plusieurs protéases sont synthétisées dans le pancréas et sécrétées dans la lumière de l’intestin grêle. Les deux principales protéases pancréatiques sont la trypsine et la chymotrypsine, qui sont synthétisées et emballées dans des vésicules sécrétoires sous forme de proenzymes inactives, le trypsinogène et le chymotrypsinogène.
Comme vous pouvez l’anticiper, les protéases sont des enzymes plutôt dangereuses à avoir dans les cellules, et l’emballage d’un précurseur inactif est un moyen pour les cellules de manipuler ces enzymes en toute sécurité. Les vésicules sécrétoires contiennent également un inhibiteur de trypsine qui sert de protection supplémentaire si une partie du trypsinogène est activée en trypsine ; après l’exocytose, cet inhibiteur est dilué et devient inefficace – la goupille est retirée de la grenade.
Une fois que le trypsinogène et le chymotrypsinogène sont libérés dans la lumière de l’intestin grêle, ils doivent être convertis en leurs formes actives afin de digérer les protéines. Le trypsinogène est activé par l’enzyme entérokinase, qui est intégrée dans la muqueuse intestinale.
Une fois que la trypsine est formée, elle active le chymotrypsinogène, ainsi que des molécules supplémentaires de trypsinogène. Le résultat net est une apparition plutôt explosive de protéase active une fois que les sécrétions pancréatiques atteignent l’intestin grêle.
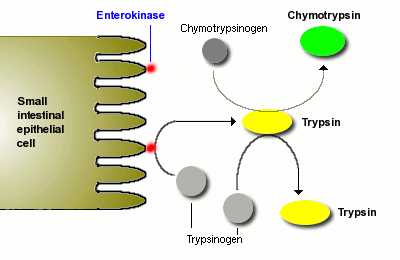
La trypsine et la chymotrypsine digèrent les protéines en peptides et les peptides en peptides plus petits, mais elles ne peuvent pas digérer les protéines et les peptides en acides aminés uniques. Certaines des autres protéases du pancréas, par exemple la carboxypeptidase, ont cette capacité, mais la digestion finale des peptides en acides aminés est en grande partie l’effet des peptidases à la surface des cellules épithéliales de l’intestin grêle. Nous y reviendrons plus tard.
2. Lipase pancréatique
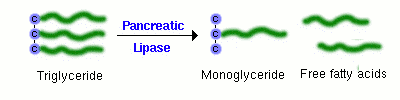
Un composant majeur des graisses alimentaires est le triglycéride, ou lipide neutre. Une molécule de triglycéride ne peut pas être absorbée directement à travers la muqueuse intestinale. Elle doit d’abord être digérée en un 2-monoglycéride et deux acides gras libres. L’enzyme qui effectue cette hydrolyse est la lipase pancréatique, qui est délivrée dans la lumière de l’intestin en tant que constituant du suc pancréatique.
Des quantités suffisantes de sels biliaires doivent également être présentes dans la lumière de l’intestin pour que la lipase puisse digérer efficacement le triglycéride alimentaire et que les acides gras et le monoglycéride qui en résultent soient absorbés. Cela signifie que la digestion et l’absorption normales des graisses alimentaires dépendent de manière critique des sécrétions du pancréas et du foie.
La lipase pancréatique a récemment été sous les feux de la rampe en tant que cible pour la gestion de l’obésité. Le médicament orlistat (Xenical) est un inhibiteur de la lipase pancréatique qui interfère avec la digestion des triglycérides et réduit ainsi l’absorption des graisses alimentaires. Des essais cliniques soutiennent l’affirmation selon laquelle l’inhibition de la lipase peut entraîner des réductions significatives du poids corporel chez certains patients.
3. Amylase
Le principal glucide alimentaire pour de nombreuses espèces est l’amidon, une forme de stockage du glucose chez les plantes. L’amylase (techniquement l’alpha-amylase) est l’enzyme qui hydrolyse l’amidon en maltose (un disaccharide glucose-glucose), ainsi que le trisaccharide maltotriose et de petits fragments de ramifications appelés dextrines limites. La principale source d’amylase chez toutes les espèces est les sécrétions pancréatiques, bien que l’amylase soit également présente dans la salive de certains animaux, dont l’homme.
Autres enzymes pancréatiques
En plus des protéases, de la lipase et de l’amylase, le pancréas produit une foule d’autres enzymes digestives, dont la ribonucléase, la désoxyribonucléase, la gélatinase et l’élastase.
Bicarbonate et eau
Les cellules épithéliales des canaux pancréatiques sont la source du bicarbonate et de l’eau sécrétés par le pancréas. Le bicarbonate est une base et il est essentiel pour neutraliser l’acide provenant de l’estomac dans l’intestin grêle. Le mécanisme qui sous-tend la sécrétion de bicarbonate est essentiellement le même que celui de la sécrétion d’acide par les cellules pariétales de l’estomac et dépend de l’enzyme anhydrase carbonique. Dans les cellules du canal pancréatique, le bicarbonate est sécrété dans la lumière du canal et donc dans le suc pancréatique.
.