Qu’est-ce que le reflux ?
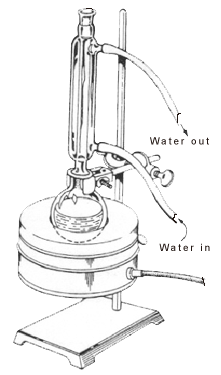
De nombreuses réactions chimiques organiques prennent beaucoup de temps à se réaliser, et pour accélérer ces réactions, on applique de la chaleur. Les composés organiques sont souvent volatils, avec des pressions de vapeur élevées et de faibles points d’ébullition. Lorsqu’ils sont chauffés dans une certaine mesure, ils deviennent inflammables et provoquent des explosions. Ainsi, l’application de la chaleur doit se faire d’une manière spécifique pour surmonter le problème de l’évaporation d’une trop grande quantité de solvant et du séchage du récipient de réaction.
Le reflux consiste à chauffer la réaction chimique pendant une durée spécifique, tout en refroidissant continuellement la vapeur produite pour la ramener sous forme liquide, à l’aide d’un condenseur. Les vapeurs produites au-dessus de la réaction subissent continuellement une condensation, retournant dans le ballon sous forme de condensat. De cette façon, il garantit que la température de la réaction reste constante.
Les réactifs pour les expériences à reflux peuvent être solides et liquides, ou tous deux liquides. La température à laquelle la réaction est chauffée dépend des points d’ébullition des solvants et aussi de l’anneau de reflux (voir ci-dessous).
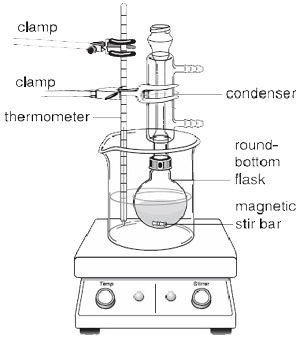
Si les réactifs ajoutés au ballon à fond rond ne sont pas trop visqueux, un barreau d’agitation magnétique peut être employé pour éviter les chocs violents du liquide en ébullition et assurer un chauffage uniforme. Comme le montre la figure 2, une plaque chauffante doit être utilisée à la place d’un manchon chauffant lorsqu’un barreau magnétique est utilisé car il contient un agitateur magnétique permettant de faire tourner le barreau automatiquement pendant que le reflux a lieu
Le condenseur est toujours complètement rempli d’eau pour assurer un refroidissement efficace. Les vapeurs, qui se dégagent du mélange réactionnel liquide, passent de la phase gazeuse à la phase liquide en raison de la perte de chaleur. Cela fait alors retomber le mélange liquide dans le ballon à fond rond.
Pendant la réaction, une partie du solvant remonte le long du tube du condenseur avant de se condenser à nouveau dans le ballon. Au-dessus de ce point, la chemise intérieure du condenseur apparaît sèche. En dessous de ce point, le solvant retourne dans le ballon. La limite entre ces deux parties est l’anneau de reflux. La température de la réaction doit être réglée de manière à ce que l’anneau de reflux ne soit qu’au tiers ou à la moitié du condenseur.
Pour savoir que le point d’ébullition a été atteint, des bulles de vapeur sont produites à l’intérieur du liquide. Si l’on augmente la vitesse de chauffage, la température des réactifs ne change pas, mais la vitesse à laquelle le liquide en ébullition passe sous forme de vapeur augmente. Cette augmentation est causée par l’apport accru d’énergie qui facilite le passage d’un plus grand nombre de molécules liquides à surmonter leurs interactions intermoléculaires pour passer en phase gazeuse.
Lorsqu’un mélange de deux ou plusieurs composés volatils est chauffé, la pression de vapeur totale (PT) du mélange est égale à la somme des pressions de vapeur des composés 1 et 2 (P1 et P2) du mélange. L’ampleur de la pression de vapeur exercée par chaque composé est déterminée par la pression de vapeur de ce composé (P0) et les fractions molaires des deux composés 1 et 2 présents dans le mélange (X1 et X2).
Pour une solution idéale à deux composés, la pression de vapeur de la solution est exprimée par la loi de Raoult, représentée par l’équation ci-dessous :
PT = X1P10 + X2P20
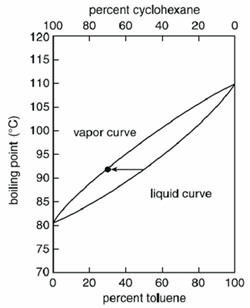
Selon le mélange, la température d’ébullition est variable. Les mélanges homogènes bouillent à une température comprise entre les points d’ébullition des composés purs, mais la valeur exacte dépend de la quantité (masse ou volume) de chaque composé.
Par exemple, un mélange liquide, lorsqu’il est porté à ébullition, donnera une vapeur qui contiendra un plus grand pourcentage du composé le plus volatil. Dans un mélange de cyclohexane et de toluène, le cyclohexane est plus volatil entre les deux et un liquide composé de 50 pour cent de cyclohexane et de 50 pour cent de toluène bouillirait à 90°C et donnerait une vapeur composée de 70 pour cent de cyclohexane et de 30 pour cent de toluène.
Lorsqu’il s’agit de séparer des composés, une méthode courante qui est utilisée en chimie organique est la distillation qui sépare les composés en fonction des différences de points d’ébullition.
Dans des expériences plus sophistiquées, le reflux et la distillation peuvent être réalisés en même temps. Par exemple, pendant qu’une réaction est à reflux, une distillation à micro-échelle peut être réalisée à l’aide d’un équipement spécialisé. La distillation à micro-échelle consiste à raccourcir le chemin de distillation pour réduire les risques de perte de matière dans le processus.
 |
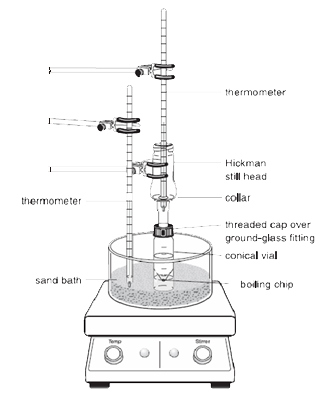 |
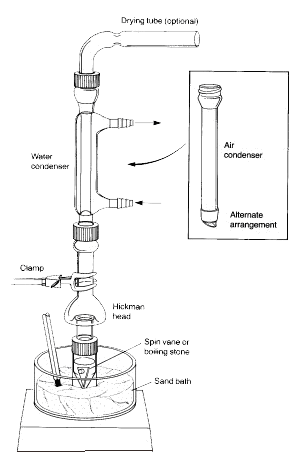
Note : Les vapeurs du liquide chauffé s’élèvent et se refroidissent pour se condenser soit sur les parois intérieures de la tête de Hickman, soit sur les parois du condenseur.
Le liquide qui s’écoule vers le bas s’accumule dans le puits circulaire au fond de l’alambic.
1.La fiole conique doit être solidement fixée à la tête de distillation Hickman et au condenseur à air à l’aide du bouchon de compression et de la pince métallique. Toutes les pièces doivent avoir un joint en verre rodé et bien s’emboîter de telle sorte qu’aucune fuite importante ne se produise.
2.La girouette doit être placée dans le flacon conique et être dirigée vers le bas. Le septum plat et le petit bouchon de compression sont utilisés pour fermer l’orifice latéral de la tête de Hickman. L’ensemble de l’installation est placé dans le trou approprié de l’Al-block ou du bain de sable et centré sur la plaque chauffante avant de commencer à remuer (sinon la palette de rotation se retournera et tournera incorrectement).
3.La tête Hickman et le condenseur à air doivent être refroidis avec une serviette en papier humide. La source de chaleur doit être réglée de manière à ce que le composé d’intérêt distille lentement.
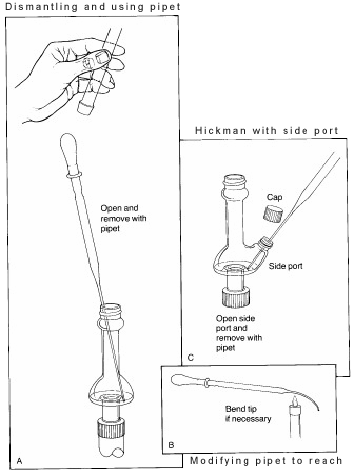
Dans le montage ci-dessus, la tête de distillation Hickman sert à la fois de condenseur à air et de récipient de collecte des condensats pour les distillations simples ou fractionnées. La tête Hickman peut être séparée en deux types : à orifice et non à orifice.
Il est plus facile de collecter les fractions avec la tête Hickman à port. Pour ce faire, le port doit être ouvert pour retirer le liquide dans le puits avec une pipette Pasteur (voir ‘C’ dans la figure 3).
Pour la tête Hickman non rapportée, la pipette Pasteur est utilisée pour aspirer le liquide par le haut. (voir ‘A’).
Si un condensateur ou un thermomètre interne est utilisé, l’appareil de distillation doit être partiellement démonté pour le faire. Dans certains alambics, le diamètre intérieur de la tête est si petit qu’il est difficile d’atteindre la tête en angle avec la pipette et d’entrer en contact avec le liquide. Pour résoudre ce problème, la pointe de la pipette doit être légèrement pliée dans une flamme.
Une fois retiré, le liquide est transféré dans un petit flacon et bouché avec un bouchon scellé au téflon.S’il y a plus d’un composé volatil dans le flacon, il sera nécessaire de commencer à basse température pour distiller d’abord le composé à plus faible point d’ébullition. De cette façon, les composés dont la différence de point d’ébullition est d’au moins 50 oC peuvent être séparés de manière relativement propre.
En fin de compte, quelques mots de conseils :
1. Le flacon conique ne doit pas être rempli à plus de la moitié afin de laisser suffisamment de place pour que le liquide puisse bouillir. Sinon, la solution se déversera ou débordera lorsqu’elle commencera à bouillir.
2. Une bonne étanchéité entre les joints minimise la perte du composé cible pendant la distillation. Il permet également d’éviter l’égouttement d’un composé sur la plaque chauffante, et un éventuel accident d’incendie.
.