Fórmulas de escrita para Compostos Iónicos Binários
Se conhece os elementos que formam um composto iónico binário, pode escrever a sua fórmula. Comece por escrever o ião metálico e a sua carga, seguido pelo ião não metálico com a sua carga. Como o composto global deve ser electricamente neutro, decidir quantos iões de cada tipo são necessários para que as cargas positivas e negativas se anulem mutuamente. Considerar o composto nitreto de alumínio. As cargas sobre cada um destes iões podem ser determinadas através da análise dos grupos em que o alumínio e o azoto se encontram na tabela periódica. Os iões são:
\
Desde que os iões tenham cargas de magnitude igual (3, mas sinais diferentes), 1:1 é a razão mais baixa de iões que produzirá um composto neutro. Uma vez que a carga sobre o alumínio é 3+ e a carga sobre o nitrogénio é ^(3-), a soma das suas cargas é zero (^(+3;+\;+\; -3=0\)). Como resultado, a fórmula do nitreto de alumínio é {\i1}ce{AlN}). Outro composto, o óxido de lítio, contém os seguintes iões:
p>> Neste caso, são necessários dois iões de lítio, cada um com uma carga de 1+, para equilibrar a carga de cada ião de óxido, que tem uma carga de {\i}(2-\i}). A fórmula do óxido de lítio é {\i_2O} porque o composto deve ser neutro. Portanto, \i(\i(2\i(2\i(1\i(2\i(2\i(2)) + 1\i(1\i(2)-2)=0)).
Para compostos em que a proporção de iões não é tão óbvia, uma forma alternativa de determinar a fórmula correcta é utilizar o método “crisscross”. Neste método, o valor numérico de cada carga cruza para se tornar o subscrito do íon oposto. Os sinais das cargas são eliminados. O método crisscross é demonstrado abaixo para o óxido de alumínio.
p>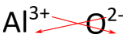 p>p> As setas vermelhas indicam que os 3 da carga {(3++) atravessarão para se tornarem o subscrito do {O}, enquanto que os 2 da carga {2} atravessarão para se tornarem o subscrito do {O}. A fórmula para o óxido de alumínio é {Al_2O_3}}.
p>p> As setas vermelhas indicam que os 3 da carga {(3++) atravessarão para se tornarem o subscrito do {O}, enquanto que os 2 da carga {2} atravessarão para se tornarem o subscrito do {O}. A fórmula para o óxido de alumínio é {Al_2O_3}}.
Para o óxido de alumínio, o método crisscross produz directamente a fórmula correcta, mas em alguns casos, é necessário outro passo. Como os compostos iónicos são sempre descritos pelas suas fórmulas empíricas, devem ser escritos como a relação de número inteiro mais baixa dos iões. No caso do nitreto de alumínio, o método crisscross produziria uma fórmula de {Al_3N_3}}, o que não é correcto. Deve ser executado um segundo passo em que os subscritos são reduzidos, mas a relação é mantida na mesma. \Pode ser reduzida a uma razão de 1:1 de iões de alumínio para iões de nitreto. Seguindo o método crisscross para escrever a fórmula para o óxido de chumbo (IV) envolveria os seguintes passos:
p>alguns metais de transição podem ter mais do que uma carga possível. Quando isto acontece, a carga sobre o cátion do metal de transição é incluída entre parênteses no nome. Por exemplo, o óxido de chumbo(IV) tem {Pb^{4+}} como seu catião metálico.
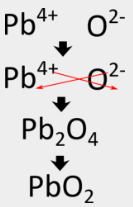 p> O método crisscross produz primeiro {Pb_2O_4}} para a fórmula, mas esta deve ser reduzida a {PbO_2}, que é a fórmula correcta.
p> O método crisscross produz primeiro {Pb_2O_4}} para a fórmula, mas esta deve ser reduzida a {PbO_2}, que é a fórmula correcta.