Écrire les formules des composés ioniques binaires
Si vous connaissez les éléments qui forment un composé ionique binaire, vous pouvez écrire sa formule. Commencez par écrire l’ion métallique et sa charge, puis l’ion non métallique avec sa charge. Comme le composé global doit être électriquement neutre, décidez du nombre d’ions de chaque type nécessaires pour que les charges positives et négatives s’annulent. Prenons l’exemple du composé nitrure d’aluminium. Les charges de chacun de ces ions peuvent être déterminées en regardant les groupes dans lesquels l’aluminium et l’azote se trouvent sur le tableau périodique. Les ions sont :
Puisque les ions ont des charges qui sont égales en magnitude (3, mais de signes différents), 1:1 est le plus petit rapport d’ions qui produira un composé neutre. La charge de l’aluminium étant de 3+ et celle de l’azote de \(3-\), la somme de leurs charges est nulle (\(+3\;+\ ; -3=0\)). Par conséquent, la formule du nitrure d’aluminium est \(\ce{AlN}\). Un autre composé, l’oxyde de lithium, contient les ions suivants :
Dans ce cas, deux ions lithium, chacun ayant une charge 1+, sont nécessaires pour équilibrer la charge de chaque ion oxyde, qui a une charge \(2-\). La formule de l’oxyde de lithium est \(\ce{Li_2O}\) car le composé doit être neutre. Par conséquent, \(\left( 2\times+1\right) \;+\left( 1\times -2\right)=0\).
Pour les composés dans lesquels le rapport des ions n’est pas aussi évident, une autre façon de déterminer la formule correcte est d’utiliser la méthode « crisscross ». Dans cette méthode, la valeur numérique de chaque charge se croise pour devenir l’indice de l’ion opposé. Les signes des charges sont supprimés. La méthode du croisement est démontrée ci-dessous pour l’oxyde d’aluminium.
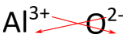
Les flèches rouges indiquent que le 3 de la charge \(3+\) se croisera pour devenir l’indice de \(\ce{O}\), tandis que le 2 de la charge \(2-\) se croisera pour devenir l’indice de \(\ce{Al}\). La formule de l’oxyde d’aluminium est \(\ce{Al_2O_3}\).
Pour l’oxyde d’aluminium, la méthode du croisement produit directement la formule correcte, mais dans certains cas, une autre étape est nécessaire. Parce que les composés ioniques sont toujours décrits par leurs formules empiriques, ils doivent être écrits comme le plus petit rapport en nombre entier des ions. Dans le cas du nitrure d’aluminium, la méthode du croisement donnerait une formule de \(\ce{Al_3N_3}\), ce qui n’est pas correct. Il faut procéder à une deuxième étape dans laquelle les indices sont réduits mais le rapport reste le même. \(\ce{Al_3N_3}\) peut être réduit à \(\ce{AlN}\), car les deux formules décrivent un rapport 1:1 entre les ions aluminium et les ions nitrure. Suivre la méthode du croisement pour écrire la formule de l’oxyde de plomb (IV) impliquerait les étapes suivantes :
Certains métaux de transition peuvent avoir plus d’une charge possible. Lorsque cela se produit, la charge du cation du métal de transition est incluse entre parenthèses dans le nom. Par exemple, l’oxyde de plomb(IV) a pour cation métallique \(\ce{Pb^{4+}}\).
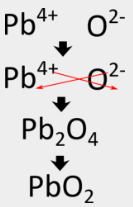
La méthode du croisement donne d’abord \(\ce{Pb_2O_4}\) pour la formule, mais celle-ci doit être réduite à \(\ce{PbO_2}\), qui est la formule correcte.