Escribiendo fórmulas para compuestos iónicos binarios
Si conoces los elementos que forman un compuesto iónico binario, puedes escribir su fórmula. Empieza escribiendo el ion metálico y su carga, seguido del ion no metálico con su carga. Como el compuesto total debe ser eléctricamente neutro, decide cuántos iones de cada tipo se necesitan para que las cargas positivas y negativas se anulen entre sí. Considere el compuesto nitruro de aluminio. Las cargas de cada uno de estos iones se pueden determinar mirando los grupos en los que se encuentran el aluminio y el nitrógeno en la tabla periódica. Los iones son:
Dado que los iones tienen cargas iguales en magnitud (3, pero de distinto signo), 1:1 es la menor proporción de iones que producirá un compuesto neutro. Como la carga del aluminio es 3+ y la del nitrógeno es \(3-\), la suma de sus cargas es cero (\(+3\;+\; -3=0\)). Como resultado, la fórmula del nitruro de aluminio es \(\ce{AlN}\). Otro compuesto, el óxido de litio, contiene los siguientes iones:
En este caso, se necesitan dos iones de litio, cada uno con una carga 1+, para equilibrar la carga de cada ion de óxido, que tiene una carga \(2-\). La fórmula del óxido de litio es \(\ce{Li_2O}\) porque el compuesto debe ser neutro. Por lo tanto, \(\left( 2\times+1\right) \\\left( 1\times -2\right)=0\).
Para los compuestos en los que la proporción de iones no es tan obvia, una forma alternativa de determinar la fórmula correcta es utilizar el método de «entrecruzamiento». En este método, el valor numérico de cada carga se cruza para convertirse en el subíndice del ion opuesto. Los signos de las cargas se eliminan. El método entrecruzado se demuestra a continuación para el óxido de aluminio.
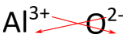
Las flechas rojas indican que el 3 de la carga \ (3+) se cruzará para convertirse en el subíndice de \ (\ce{O}\), mientras que el 2 de la carga \ (2-\) se cruzará para convertirse en el subíndice de \ (\ce{Al}\). La fórmula del óxido de aluminio es \(\ce{Al_2O_3}).
Para el óxido de aluminio, el método de entrecruzamiento produce directamente la fórmula correcta, pero en algunos casos, se requiere otro paso. Debido a que los compuestos iónicos siempre se describen por sus fórmulas empíricas, deben escribirse como la menor proporción de números enteros de los iones. En el caso del nitruro de aluminio, el método de cruzamiento daría una fórmula de \ce{Al_3N_3}\, que no es correcta. Hay que realizar un segundo paso en el que se reducen los subíndices pero se mantiene la relación. \(\ce{Al_3N_3}} puede reducirse a \ce{AlN}}, porque ambas fórmulas describen una proporción 1:1 de iones de aluminio e iones de nitruro. Siguiendo el método cruzado para escribir la fórmula del óxido de plomo (IV) habría que seguir los siguientes pasos:
Algunos metales de transición pueden tener más de una carga posible. Cuando esto ocurre, la carga del catión del metal de transición se incluye entre paréntesis en el nombre. Por ejemplo, el óxido de plomo(IV) tiene \ce{Pb^{4+}} como su catión metálico.
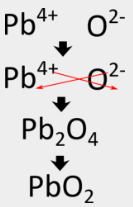
El método entrecruzado primero da como resultado \ce{Pb_2O_4} para la fórmula, pero eso debe reducirse a \ce{PbO_2}}, que es la fórmula correcta.