¿Qué es la transposición completa de las grandes arterias?
La transposición completa de las grandes arterias (TOGA) se produce cuando la aorta, que normalmente sale del ventrículo izquierdo y bombea sangre roja al cuerpo, surge del ventrículo derecho (1) y bombea la sangre azul que regresa del cuerpo de vuelta al cuerpo evitando los pulmones por completo. La arteria pulmonar, que normalmente nace del ventrículo derecho y bombea sangre azul a los pulmones, nace del ventrículo izquierdo (2) y envía la sangre roja que regresa de los pulmones directamente a éstos. Esencialmente, las grandes arterias están invertidas de sus conexiones normales.
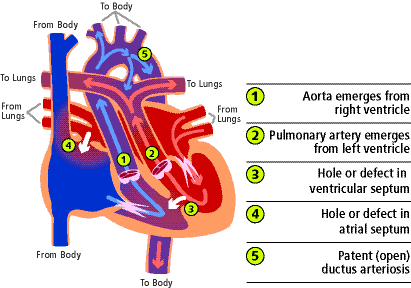
La causa del problema no se entiende. Es la forma más común de cardiopatía congénita cianótica que se presenta en el periodo neonatal. Es más frecuente en los varones y los bebés suelen tener un peso y tamaño normales al nacer. El TOGA representa entre el 5 y el 7% de todas las cardiopatías congénitas.
Hay varias otras anomalías cardíacas que pueden presentarse junto con el TOGA. El problema asociado más común es una comunicación interventricular (3). Se trata de un defecto o agujero en la pared que separa las dos cámaras inferiores del corazón, los ventrículos. Puede haber un estrechamiento de la zona del corazón por la que sale la sangre hacia la arteria pulmonar. Esto se denomina obstrucción del tracto de salida del ventrículo izquierdo.
Muchos de estos bebés tienen una comunicación interauricular (4) (un agujero en la pared que separa las dos cámaras superiores del corazón) y/o un conducto arterioso persistente (5). Se trata de un canal normal de nacimiento entre la aorta y la arteria pulmonar presente al nacer que puede no cerrarse en presencia de otros problemas cardíacos.
¿Cuáles son los efectos de este defecto en la salud de mi hijo?
Cuando un bebé tiene TOGA, hay dos circuitos separados de flujo sanguíneo en lugar de uno conectado. La sangre azul que regresa del cuerpo es bombeada de vuelta al cuerpo y la sangre roja que regresa de los pulmones es bombeada de vuelta a los pulmones. Como resultado, el bebé desarrolla un color azul, llamado cianosis, poco después del nacimiento. El color azul se aprecia mejor en los labios o bajo las uñas. En un bebé con cianosis relacionada con el corazón, el color azul no mejora con el uso de oxígeno.
Si esta situación continuara, el bebé podría morir pronto por falta de suministro de oxígeno al cuerpo. La única manera de que un bebé con TOGA pueda sobrevivir después del nacimiento es que haya una forma de que la sangre roja y azul se mezclen dentro del corazón para que parte de la sangre roja sea bombeada al cuerpo. Una comunicación interauricular y/o un conducto arterioso persistente suelen permitir que el bebé reciba suficiente oxígeno para sobrevivir hasta que se pueda realizar una intervención más definitiva.
Algunos bebés con TGA también tienen un agujero entre las cámaras inferiores del corazón denominado comunicación interventricular. Si esto está presente, puede producirse una mezcla de sangre suficiente como para que el bebé no parezca cianótico en absoluto y, de hecho, puede enfermar con síntomas de insuficiencia cardíaca congestiva debido al flujo de sangre adicional que va a los pulmones. Entonces el bebé tendrá síntomas de mala alimentación, escaso aumento de peso, sudoración y respiración rápida o dificultosa.
Por último, puede haber un estrechamiento de la zona que sale del ventrículo izquierdo hacia la arteria pulmonar llamado obstrucción del tracto de salida del ventrículo izquierdo. En esta situación, aunque exista el orificio para que la sangre se mezcle, la cantidad total de flujo sanguíneo que llega a los pulmones se reduce. El grado de estrechamiento varía y puede ser leve al principio, pero puede empeorar con el tiempo. A medida que el estrechamiento aumenta, la coloración del bebé será más cianótica (azul).
La gravedad de los síntomas depende de la cantidad de sangre roja y azul que se mezcle y de la presencia o ausencia de obstrucción del flujo sanguíneo que sale del ventrículo izquierdo. El tipo y el momento de la operación dependen de la combinación de defectos que acompañan al problema primario de la TGA.
Los bebés con TGA pueden desarrollar una enfermedad vascular pulmonar temprana. Se trata de un aumento de la presión en los vasos sanguíneos pulmonares que provoca cambios que les dificultan aceptar el flujo de sangre a baja presión. Estos cambios pueden producirse a las pocas semanas de vida y suelen ser más frecuentes en los bebés que tienen defectos del tabique ventricular además de la TGA. La cirugía correctiva temprana minimiza las posibilidades de desarrollo de una resistencia vascular pulmonar elevada en estos bebés.
¿Cómo se diagnostica este defecto?
Características clínicas: Como se ha descrito anteriormente, los bebés con TOGA completo tienen niveles de oxígeno en sangre más bajos desde el momento del nacimiento. El color azul se observa en los labios y bajo el lecho de las uñas y puede ser bastante difícil de detectar con sólo mirar al bebé. Se desarrollan signos de insuficiencia congestiva que incluyen síntomas de insuficiencia cardíaca congestiva, como sudoración excesiva (un sudor frío y pegajoso que a menudo se observa durante la alimentación); una alimentación deficiente, un aumento de peso lento, irritabilidad o letargo, y/o respiración rápida suelen desarrollarse durante el período neonatal.
Hallazgos físicos: El TOGA completo se suele diagnosticar con 24 a 48 horas de vida debido a la presencia de cianosis que es moderada o grave en la mayoría de los casos. El segundo ruido cardíaco es fuerte y único. Puede haber o no un soplo dependiendo de la presencia de una comunicación interventricular. Si el bebé tiene insuficiencia cardíaca congestiva, la frecuencia respiratoria será rápida y el hígado estará agrandado.
Pruebas médicas: Los niveles de oxígeno en sangre pueden medirse mediante una prueba de saturación de oxígeno o mediante un análisis de sangre. A veces se coloca al bebé en una tienda de oxígeno y se le da oxígeno al 100% para que respire y así ver si los niveles de oxígeno en sangre aumentan. Si los niveles de oxígeno aumentan significativamente, esto sugiere que el bajo nivel de oxígeno se debe a un problema pulmonar en lugar de un problema cardíaco.
También se suele realizar un electrocardiograma y una radiografía de tórax. El defecto se diagnostica mediante una prueba cardíaca denominada ecocardiograma o ecografía cardíaca. El ecocardiograma utiliza ondas sonoras para formar una imagen de las válvulas y cámaras del interior del corazón. Es seguro e indoloro y los resultados de la prueba están disponibles de inmediato. En algunos casos, el diagnóstico se realiza antes del nacimiento durante una ecografía fetal. El momento más temprano en el que se puede utilizar la prueba para diagnosticar este problema es cuando la madre tiene 18 semanas de embarazo.
Será necesaria otra prueba cardíaca denominada cateterismo cardíaco si el ecocardiograma no aclara completamente el problema cardíaco o si existen anomalías adicionales que pueden afectar a la forma en que el cirujano solucionaría el defecto. Durante este procedimiento, se colocan catéteres (tubos finos de plástico) en los grandes vasos sanguíneos situados en la zona de la ingle y se guían suavemente hasta el corazón. A continuación se introduce un contraste o «tinte» en el corazón para poder tomar imágenes de rayos X. También se obtienen mediciones de presión y niveles de oxígeno. Es más complicado que el ecocardiograma, pero se considera muy seguro. Los bebés están sedados y se les administran analgésicos durante la prueba. Los resultados suelen estar disponibles el mismo día.
Clínicas
La atención y los servicios para los pacientes con este problema se ofrecen en las clínicas de Corazón Congénito y Cirugía Cardiovascular del Sistema de Salud de la Universidad de Michigan en Ann Arbor.
¿Cómo se trata el problema?
Tratamientos Parte 1 | Tratamientos Parte 2
Lupinetti FM, Bove EL, Snider AR, Callow LB, Meliones JN, Crowley DC, Beekman RH, Minich LL, Rosenthal A: Supervivencia a medio plazo y resultados funcionales tras la reparación arterial de la transposición de las grandes arterias. J Thorac Cardiovasc Surg 1992;103:421-7.
Bove EL, Beekman RH, Snider AR, Rocchini AP, Dick M, Crowley DC, Serwer GS, Rosenthal A: Arterial repair for transposition and large ventricular septal defect in early infancy. Circulation l988;78 (Suppl III):III-26-III-3l.
Escrito por: Louise Callow RN, MSN (12/99)
Revisado en septiembre de 2012