Scrivere formule per composti ionici binari
Se conosci gli elementi che formano un composto ionico binario, puoi scrivere la sua formula. Inizia scrivendo lo ione metallico e la sua carica, seguito dallo ione non metallico con la sua carica. Poiché il composto complessivo deve essere elettricamente neutro, decidi quanti ioni di ogni tipo sono necessari affinché le cariche positive e negative si annullino a vicenda. Considera il nitruro di alluminio composto. Le cariche di ciascuno di questi ioni possono essere determinate guardando i gruppi in cui l’alluminio e l’azoto si trovano sulla tavola periodica. Gli ioni sono:
Poiché gli ioni hanno cariche che sono uguali in grandezza (3, ma segni diversi), 1:1 è il rapporto più basso di ioni che produrrà un composto neutro. Poiché la carica dell’alluminio è 3+ e la carica dell’azoto è \(3-\), la somma delle loro cariche è zero (\(+3\;+\; -3=0\)). Di conseguenza, la formula del nitruro di alluminio è \(\ce{AlN}\). Un altro composto, l’ossido di litio, contiene i seguenti ioni:
In questo caso, due ioni di litio, ciascuno con una carica 1+, sono necessari per bilanciare la carica di ogni ione di ossido, che ha una carica \(2-\). La formula dell’ossido di litio è \(\ce{Li_2O}\ perché il composto deve essere neutro. Quindi, \(\sinistra( 2 volte+1 destra) \;+\sinistra( 1 volta -2 destra)=0\).
Per i composti in cui il rapporto degli ioni non è così ovvio, un modo alternativo per determinare la formula corretta è di usare il metodo “incrociato”. In questo metodo, il valore numerico di ogni carica si incrocia per diventare il pedice dello ione opposto. I segni delle cariche sono abbandonati. Il metodo incrociato è dimostrato qui sotto per l’ossido di alluminio.
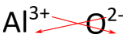
Le frecce rosse indicano che il 3 della carica \(3+) si incrocia per diventare il pedice di \(\ce{O}), mentre il 2 della carica \(2-\) si incrocia per diventare il pedice di \(\ce{Al}). La formula per l’ossido di alluminio è \(\ce{Al_2O_3}\).
Per l’ossido di alluminio, il metodo incrociato produce direttamente la formula corretta, ma in alcuni casi, è necessario un altro passo. Poiché i composti ionici sono sempre descritti dalle loro formule empiriche, devono essere scritti come il più basso rapporto di numeri interi degli ioni. Nel caso del nitruro di alluminio, il metodo incrociato produrrebbe una formula di \(\ce{Al_3N_3}\), che non è corretta. Un secondo passo deve essere eseguito in cui i pedici sono ridotti ma il rapporto è mantenuto lo stesso. \(\ce{Al_3N_3}\ può essere ridotto a \(\ce{AlN}\), perché entrambe le formule descrivono un rapporto 1:1 tra ioni alluminio e ioni nitruro. Seguendo il metodo incrociato per scrivere la formula per l’ossido di piombo (IV) comporterebbe i seguenti passi:
Alcuni metalli di transizione possono avere più di una carica possibile. Quando questo accade, la carica sul catione del metallo di transizione è inclusa tra parentesi nel nome. Per esempio, l’ossido di piombo (IV) ha \(\ce{Pb^{4+}} come catione metallico.
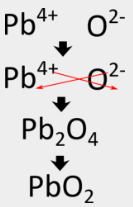
Il metodo incrociato produce prima \(\ce{Pb_2O_4}} come formula, ma questa deve essere ridotta a \(\ce{PbO_2}\), che è la formula corretta.