Qu’est-ce que la transposition complète des grandes artères ?
La transposition complète des grandes artères (TOGA) se produit lorsque l’aorte, qui provient normalement du ventricule gauche et pompe le sang rouge vers le corps, surgit du ventricule droit (1) et pompe le sang bleu revenant du corps vers le corps en contournant complètement les poumons. L’artère pulmonaire, qui naît normalement du ventricule droit et pompe le sang bleu vers les poumons, naît du ventricule gauche (2) et renvoie le sang rouge revenant des poumons directement vers les poumons. Essentiellement, les grandes artères sont inversées par rapport à leurs connexions normales.
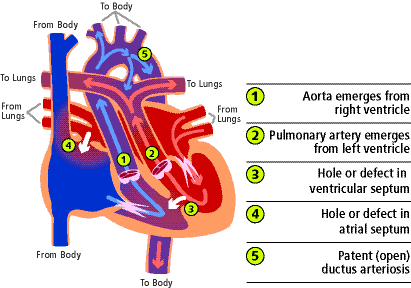
La cause du problème n’est pas comprise. Il s’agit de la forme la plus courante de cardiopathie congénitale cyanosée qui se présente dans la période néonatale. Elle est plus fréquente chez les garçons et les bébés ont généralement un poids et une taille normaux à la naissance. Le TOGA représente 5 à 7% de toutes les malformations cardiaques congénitales.
Il existe plusieurs autres anomalies cardiaques qui peuvent survenir en même temps que le TOGA. Le problème associé le plus courant est une communication interventriculaire (3). Il s’agit d’un défaut ou d’un trou dans la paroi qui sépare les deux chambres inférieures du cœur, les ventricules. Il peut y avoir un rétrécissement de la zone du cœur où le sang s’écoule vers l’artère pulmonaire. C’est ce qu’on appelle l’obstruction de la voie de sortie du ventricule gauche.
Beaucoup de ces bébés ont une communication interauriculaire (4) (un trou dans la paroi qui sépare les deux chambres supérieures du cœur) et/ou un canal artériel persistant (5). Il s’agit d’un canal normal de naissance entre l’aorte et l’artère pulmonaire présent à la naissance qui peut ne pas se fermer en présence d’autres problèmes cardiaques.
Quels sont les effets de cette anomalie sur la santé de mon enfant ?
Lorsqu’un bébé est atteint de TOGA, il y a deux circuits séparés de circulation sanguine au lieu d’un circuit connecté. Le sang bleu qui revient du corps est pompé directement vers le corps et le sang rouge qui revient des poumons est pompé directement vers les poumons. En conséquence, le bébé développe une couleur bleue, appelée cyanose, peu après la naissance. La couleur bleue est surtout visible sur les lèvres ou sous les ongles. Chez un bébé atteint de cyanose liée au cœur, la couleur bleue ne s’améliore pas avec l’utilisation d’oxygène.
Si cette situation devait perdurer, le bébé pourrait bientôt mourir par manque d’apport d’oxygène à son corps. Le seul moyen pour qu’un bébé atteint de TOGA puisse survivre après la naissance est qu’il existe un moyen pour que le sang rouge et le sang bleu se mélangent au sein du cœur afin qu’une partie du sang rouge soit pompée vers le corps. Une communication interauriculaire et/ou un canal artériel persistant permettent généralement d’obtenir suffisamment d’oxygène pour permettre au bébé de survivre jusqu’à ce qu’une intervention plus définitive puisse être effectuée.
Certains bébés atteints de TGA ont également un trou entre les chambres inférieures du cœur appelé communication interventriculaire. Si cette anomalie est présente, il peut se produire un mélange suffisant de sang pour que le bébé n’apparaisse pas du tout cyanosé et puisse en fait tomber malade avec des symptômes d’insuffisance cardiaque congestive en raison du flux sanguin supplémentaire allant aux poumons. Le bébé présentera alors des symptômes de mauvaise alimentation, de faible prise de poids, de transpiration et de respiration rapide ou laborieuse.
Enfin, il peut y avoir un rétrécissement de la zone menant du ventricule gauche à l’artère pulmonaire appelé obstruction de la voie de sortie du ventricule gauche. Dans cette situation, même s’il y a le trou pour que le sang se mélange, la quantité totale de flux sanguin allant dans les poumons est réduite. Le degré de rétrécissement varie et peut être léger au début, mais peut s’aggraver avec le temps. Au fur et à mesure que le rétrécissement augmente, la coloration du bébé deviendra plus cyanosée (bleue).
La gravité des symptômes dépend de la quantité de sang rouge et bleu qui se mélange et de la présence ou de l’absence d’obstruction au flux sanguin sortant du ventricule gauche. Le type et le moment de l’opération dépendent de la combinaison de défauts qui accompagnent le problème primaire du TGA.
Les bébés atteints de TGA peuvent développer une maladie vasculaire pulmonaire précoce. Il s’agit d’une augmentation de la pression dans les vaisseaux sanguins pulmonaires qui provoque des changements qui les empêchent d’accepter un flux sanguin à basse pression. Ces changements peuvent survenir dès quelques semaines de vie et ont tendance à être plus fréquents chez les bébés qui présentent une communication interventriculaire en plus du TGA. Une chirurgie correctrice précoce minimise les chances de développement d’une résistance vasculaire pulmonaire élevée chez ces bébés.
Comment cette anomalie est-elle diagnostiquée ?
Caractéristiques cliniques : Comme décrit ci-dessus, les bébés atteints de TOGA complet ont un taux d’oxygène sanguin plus faible dès la naissance. La couleur bleue est observée dans les lèvres et sous les lits des ongles et peut être assez difficile à détecter simplement en regardant le bébé. Des signes d’insuffisance congestive incluant des symptômes d’insuffisance cardiaque congestive se développent, notamment une transpiration excessive (une sueur froide et moite souvent notée pendant l’alimentation) ; une mauvaise alimentation, une prise de poids lente, une irritabilité ou une léthargie, et/ou une respiration rapide se développent généralement pendant la période néonatale.
Les résultats physiques : Le TOGA complet est généralement diagnostiqué avec 24 à 48 heures de la naissance en raison de la présence d’une cyanose qui est modérée ou sévère dans la plupart des cas. Le deuxième bruit du cœur est fort et unique. Il peut y avoir ou non un souffle, selon la présence d’une communication interventriculaire. Si le bébé est en insuffisance cardiaque congestive, la fréquence respiratoire sera rapide et le foie sera hypertrophié.
Tests médicaux : Le taux d’oxygène dans le sang peut être mesuré par un test de saturation en oxygène ou par une analyse de sang. Parfois, le bébé sera placé dans une tente à oxygène et on lui donnera 100 % d’oxygène à respirer afin de voir si les niveaux d’oxygène dans le sang augmentent. Si les niveaux d’oxygène augmentent de manière significative, cela suggère que le faible niveau d’oxygène si d’un problème pulmonaire au lieu d’un problème cardiaque.
Un électrocardiogramme et une radiographie pulmonaire sont également généralement effectués. Le défaut est diagnostiqué par un test cardiaque appelé échocardiogramme ou échographie cardiaque. L’échocardiogramme utilise des ondes sonores pour former une image des valves et des chambres à l’intérieur du cœur. Cet examen est sûr et indolore et les résultats sont disponibles immédiatement. Dans certains cas, le diagnostic est posé avant la naissance au cours d’une échographie fœtale. Le test peut être utilisé au plus tôt pour diagnostiquer ce problème lorsque la mère est à 18 semaines de grossesse.
Un autre test cardiaque appelé cathétérisme cardiaque sera nécessaire si l’échocardiogramme n’est pas complètement clair sur le problème cardiaque ou si des anomalies supplémentaires sont présentes et peuvent affecter la façon dont le chirurgien corrigerait le défaut. Au cours de cette procédure, des cathéters (tubes en plastique fins) sont placés dans les gros vaisseaux sanguins situés dans la région de l’aine et guidés doucement jusqu’au cœur. Un produit de contraste ou « colorant » est ensuite introduit dans le cœur pour permettre la réalisation de clichés radiographiques. Des mesures de la pression et des niveaux d’oxygène sont également obtenus. Cet examen est plus complexe que l’échocardiogramme, mais il est considéré comme très sûr. Les bébés sont mis sous sédatif et reçoivent des médicaments contre la douleur pendant l’examen. Les résultats sont le plus souvent disponibles le jour même.
Cliniques
Les soins et les services pour les patients atteints de ce problème sont fournis dans les cliniques de cardiologie congénitale et de chirurgie cardiovasculaire de l’University of Michigan Health System à Ann Arbor.
Comment le problème est-il traité ?
Traitements partie 1 | Traitements partie 2
Lupinetti FM, Bove EL, Snider AR, Callow LB, Meliones JN, Crowley DC, Beekman RH, Minich LL, Rosenthal A : survie à moyen terme et résultats fonctionnels après réparation artérielle pour transposition des grandes artères. J Thorac Cardiovasc Surg 1992;103:421-7.
Bove EL, Beekman RH, Snider AR, Rocchini AP, Dick M, Crowley DC, Serwer GS, Rosenthal A : Réparation artérielle pour transposition et grande communication interventriculaire dans la petite enfance. Circulation l988;78 (Suppl III):III-26-III-3l.
Écrit par : Louise Callow RN, MSN (12/99)
Révisé en septembre 2012
.